组织工程化技术在韧带重建中的应用
2016-06-21 文章来源:《关节镜:关节镜及相关外科杂志(中文版)》 作者:MaCalus V. Hogan, M.D., Yohei Kawakami, M.D., Ph.D., Christopher D. Murawski, B.S.,and Freddie H. Fu, M.D. 我要说
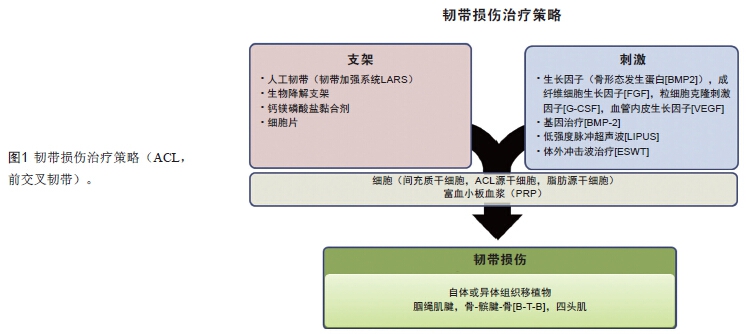
膝关节韧带损伤是一种最常见的运动医学疾病,而前交叉韧带(anterior cruciate ligament,ACL) 破裂又是一种最常见的创伤性膝关节韧带损伤,美国每年开展约10万~20万台ACL 重建手术。大多数患者的ACL 损伤无法自行愈合,主要是由于ACL 的自行愈合能力差,并且常通过自体或异体肌腱移植进行ACL 外科重建。文献报道的ACL 重建后移植物失败率介于0~14%。此外,ACL 重建的自体移植物获取与膝前疼痛、膝活动范围下降和肌力减弱有关。同种异体移植肌腱已被证实会增加异体免疫反应和传播疾病的风险。此外,同种异体移植物组织的需求增加,可能会引起供体缺乏。
成功愈合是重建手术的重要方面,尤其是腱- 韧带骨界面,因为此处有炎性细胞和骨髓来源干细胞的募集和浸润。然而,在移植后早期阶段,韧带与骨连接处为最薄弱的区域。促进移植物骨隧道愈合的加速及成熟是至关重要的因素,有利于更早、更快地康复。肌腱附着在骨面的是高度特异和整合的组织,其作用是从软组织向骨传递复杂机械应力。ACL 附着部位的特征是存在连接软组织与深部骨结构的纤维软骨组织,相对应的附着区则由四种不同类型的组织移行而成:肌腱、纤维软骨、矿化纤维软骨和骨。
在愈合过程中,原有的腱- 骨界面的结构与组成是不能被重建的,这导致重建界面的力学性能与组织结构均较差,这种有缺陷的嵌入点微结构增加了对腱- 骨融合以及随后导致肌腱附着处愈合失败风险的担忧。由于纤维软骨区域的相对无血管和损伤部位的骨丢失,腱- 骨愈合较慢,无法与骨- 骨愈合相比。腱-骨愈合过程大体可分为以下四个阶段:(1)炎症期;(2)增生期;(3)基质合成期;(4)基质塑形期。在此过程中,机械和生物学的因素均参与重建肌腱的愈合过程。根据既往报道,自然腱- 骨愈合效率不高,常导致腱- 骨界面上形成纤维瘢痕样组织层。这种不成熟的纤维层极不牢固,并会显著影响移植物在骨隧道中的稳定性。因此,已有很多针对腱- 骨愈合的研究。
在过去十年间,骨科基础研究已经对加快和改善腱-骨愈合的生物学策略进行了详细深入地探讨。这些策略主要旨在利用生长因子、细胞疗法以及其他各种转化诱导方法,增加腱- 骨界面的生物性愈合。许多研究提出了多种促进重建韧带愈合和再生的实验方法,如采用干细胞及生长因子的组织工程技术,以及基于细胞疗法和组织工程支架的复合策略(图1)。
本研究旨在提供关于目前用于膝关节韧带重建的“组织工程”策略的基础科学和转化知识。本文综述了关于膝关节韧带组织工程治疗的现有文献及可能的未来研究方向。
方法
在PubMed 及Medline 检索系统中输入检索词“kneeAND ligament”AND“tissue engineering”OR“regenerativemedicine”。两位检索员(M.V.H.,Y.K.)进行检索,然后独立评估检索结果,并提取出相关数据用于分析。对临床及临床前研究均进行审阅。Ⅴ级证据及非英语研究被排除。
结果
最初在PubMed 中检索出224 篇文章。临床及临床前研究均被纳入。将针对膝关节韧带组织工程策略的研究进一步分为亚组:细胞疗法,富血小板血浆(platelet-rich plasma,PRP)和生长因子治疗,复合生物材料,支架开发,以及机械性刺激方法。在检索中未发现符合纳入标准的随机对照试验。
讨论
细胞疗法
近年来,应用干细胞的组织工程疗法研究已显示出加快肌腱移植物愈合并融合入骨隧道的潜能。间充质干细胞由于具有高分化率、多向分化潜能以及相对容易从多种组织中分离的特点,在促进肌腱和腱- 骨愈合方面具有很强的吸引力。
研究表明,血管内富含特征性表达CD34 表面标志的干细胞/ 祖细胞。Matsumoto 等[27] 最近报告,人ACL 损伤及附近区域富含表达CD34、具有高增殖性及多向分化潜能的血管源性干细胞,这类细胞能迁移到ACL 损伤区域以促进韧带愈合。而且在ACL 损伤的大鼠模型中,研究者还发现干细胞能通过增强血管生成及骨形成而促进腱- 骨愈合。因此,为了使干细胞更直接地到达腱- 骨隧道部位,Mifune等研发了一种细胞片包裹的肌腱移植物,并表明与其他技术相比,ACL 来源的CD34+ 细胞片移植能更有效地促进ACL 重建后恢复,不仅包括骨- 腱愈合,也包括移植物成熟。
其他细胞来源也已被开发用于ACL 修复。Lui 和Wong报告,由髌腱分离的腱源性干细胞具有干细胞特性及更高的成骨分化特性。此外,Chang 等[35] 研究表明骨膜祖细胞片在增强腱- 骨交界处愈合方面提供了一种可行的治疗方法。在韧带重建中,脂肪干细胞也是一种可选择的细胞治疗方法[36]。
人工韧带系统
30 年前采用的非可降解人工韧带由于失败率过高而未被广泛接受。在过去,韧带增强系统(LARS 韧带;Surgical Implants and Devices, Arc-sur-Tille, France) 在ACL 及后交叉韧带(posterior cruciate ligament,PCL)重建中显示了安全、满意的效果。韧带增强系统是采用聚对苯二甲酸乙二酯制成的非可降解的人工移植物,在移植后具有很好的机械耐用性,但有一定的术后并发症风险。Guidoin 等分析了由于移植物断裂及发生滑膜炎而摘除的117 例移植物,发现在聚酯韧带内有巨噬细胞及巨细胞浸润的慢性炎症反应。在愈合过程中,类似瘢痕组织的散在分布的胶原组织浸润到纤维间,从而破坏韧带编织整体结构,最终引起移植失败。这种失败表明,移植后的聚乙烯对苯二甲酸乙二酯人工韧带在膝关节内“韧带化”很差。虽然人工韧带在替代自体或异体移植物方面表现出良好的前景,但这一领域仍需要更多进展。
富血小板血浆
PRP 是一种从自体全血中提取的含有超过生理浓度血小板成分的血浆,因具有治疗包括ACL 及其他韧带损伤在内的肌肉骨骼损伤的潜力而愈来愈受到科学界的关注。PRP 治疗有益的理论依据是其能提高活性PRP 释放的生产因子及活性蛋白浓度,例如有助于组织再生的血小板源性生长因子、血管内皮生长因子以及转化生长因子β。PRP 的应用激发了研究损伤部位微环境中化学介质的热情,包括血小板α- 颗粒衍生因子。
一些研究人员已通过体外及动物实验研究表明,PRP 在腱- 骨愈合中对成骨细胞及肌腱细胞增殖有积极影响。除PRP 对修复细胞的刺激效应外, 也有报道称PRP 可抑制某些在愈合早期具有不良效应的促炎细胞因子,尤其是抑制活化巨噬细胞释放的白细胞介素1(interleukin-1,IL-1)。Xie 等在犬模型中发现PRP 可促进血管和神经再生,这或许可以解释PRP对ACL 移植物成熟的促进作用。
在用于人ACL 重建时,PRP疗法允许向生理结合部位输送多种细胞因子和生长因子,从而可能解决单一疗法的局限性。迄今为止,尽管基础科学研究已显示出PRP 疗法促进腱- 骨愈合的积极作用,但是在临床疗效、隧道扩大及移植物融合方面,用于ACL 重建的PRP 增强作用物并无统计学明显差异。另一方面,一些研究者报道了在采用骨- 髌腱- 骨重建ACL 后,PRP可用于减轻供区的主观疼痛。
生长因子和细胞因子
成骨诱导生长因子的应用是增强腱- 骨愈合的研究热门之一,这些生长因子包括转化生长因子、骨形态发生蛋白、成纤维细胞生长因子及粒细胞克隆刺激因子。在ACL重建的动物模型中,生长因子在ACL 修复与愈合方面已显示出积极的效果。在上述研究结果的基础上,成骨诱导生长因子在ACL 重建方面也具有治疗潜能。
磷酸钙杂交腱
在ACL 重建中,磷酸钙生物黏合剂能够提供有利于生长界面上细胞增殖及生长因子募集的骨传导及生物相容的环境,故可作为一种替代性治疗方法促进腱- 骨愈合。Mutsuzaki 等在兔模型中采用磷酸钙杂交腱以增强ACL移植物腱- 骨界面的愈合,并且再生了一种类似正常健康ACL 肌腱附着区的结构。
可降解的生物材料
基于聚左旋乳酸和基于聚左旋乳酸基/ 聚乳酸- 羟基乙酸的螺钉常被用于ACL 修复。可生物降解的植入物应在提供早期坚强固定作用的同时,尽可能减少对移植物的损伤。Emond 等最近的一篇Ⅱ级荟萃分析表明,生物可吸收螺钉与金属螺钉在ACL重建的临床疗效方面没有显著性差异。然而,使用可生物吸收界面的螺钉会带来一些担忧,如:术中螺钉断裂,炎症反应导致吸收加速或不完全,关节积液,螺钉松动,以及骨隧道增宽的可能性。Pereira 等在综述中提到,松动是可生物吸收螺钉的潜在并发症。可生物降解螺钉的相关临床并发症信息仍然很少,并且可能存在发表偏倚。并且,在可控的实验条件下很难复制人体对此类螺钉的复杂反应。但是可以明确的是,在生物相容性固定物的发展方面,材料科学的进展将继续发挥重要作用。
Farraro 等展示了镁界面螺钉用于ACL重建时的移植物固定效果,关节稳定性及移植物功能可恢复到钛螺钉固定水平。另外,镁环修复的ACL能够桥接损伤ACL两端间的裂隙,进而使关节稳定性和功能恢复到接近正常水平。然而在广泛应用于临床前仍然面临着大量挑战,其中最显著的是如何控制腐蚀速率,这主要取决于移植物的几何特性、组成及移植部位。
Murray 和Fleming提出了一种新的ACL 损伤治疗方法,名为生物增强ACL 修复。他们之前已证明,在猪模型中,生物活性支架(一种胶原蛋白血小板复合物)的使用可显著改善传统ACL 修补缝合的效果,生物增强ACL 修复的结构性能与常规ACL 重建的效果相当。另外,在临床前试验中,生物增强ACL 修复能减少创伤后骨关节炎的发生。然而,临床前试验不同于人体试验,下一步应当研究这种方法的临床安全性和有效性。
机械刺激
刺激能量为30 mW/cm2 的低强度脉冲超声波(lowintensitypulsed ultrasound,LIPUS)是由美国食品药品管理局批准的有效干预手段,已被广泛用于增强慢性骨不连及骨折中的骨愈合,以及软骨缺损和韧带损伤的治疗。近期动物研究显示,超声不仅可以促进腱- 骨愈合,还能产生类似于天然腱末端的连接点。这可能是LIPUS 治疗可促进肌腱末端愈合的原因。LIPUS 治疗可促进成骨细胞和成纤维细胞增殖,这有助于胶原形成和骨重塑。血管内皮生长因子和IL-1β水平增加可在最初的缺血性环境中促进血管生成和蛋白质合成。此外,LIPUS 治疗能提高骨形态发生蛋白的表达水平,进而加强腱-骨愈合。LIPUS 可改善局部血液灌注和血管生成,刺激软骨成熟,增强成骨细胞的分化和增殖,并刺激间充质干细胞的成骨分化。因此,LIPUS 似乎是ACL重建后早期修复阶段促进腱- 骨愈合的有前景的无创性工具。可以想象,在家中也可利用LIPUS 刺激腱-骨隧道愈合,以达到促进康复和早日恢复正常活动的目标。
在延迟腱-骨嵌入愈合模型中,在愈合界面体外冲击波治疗被用来增强纤维软骨再生。体外冲击波治疗可提供机械刺激,并上调纤维软骨相关标志物和细胞因子的表达水平。
内、外侧副韧带
内侧副韧带(medial collateral ligament,MCL)撕裂,尤其是股骨内侧髁上的撕裂,很可能不需手术干预也可愈合,此类情况下首选非手术治疗。一般而言,关节外韧带的自愈过程可分为四个阶段,包括血肿形成、细胞增殖、基质沉积,以及组织结构化与合成。尽管MCL 损伤后功能恢复和康复较快,但力学和生物学研究已证实,即使在伤后数年,愈合后MCL 的组成成分仍低于正常MCL。在这一点上,用于修复和/ 或重建MCL 的组织工程方法已被认为可使组织类型恢复至接近正常,因而是一个值得研究的方向。
Aragonal 等在一项经典的犬动物模型研究中,尝试采用一种由碳纤维- 聚乳酸聚合物构成的部分可吸收组织支架重建MCL,发现与有瘢痕的组织相比,植入后26 周内这种新材料更稳定。Musahl 等报告在兔模型中应用猪小肠黏膜下层(small intestine submucosa,SIS),以评估SIS 能否促进MCL 损伤裂隙的愈合。结果显示,SIS提高了术后12 周时MCL 愈合的力学性能和组织学形态。Liang 等[85] 通过较长期的研究(随访至术后26 周)证明了上述短期效果。Liang 等还进一步研究了SIS 增强裂隙损伤模型,发现SIS 能显著减少Ⅴ型胶原、蛋白多糖及二聚糖的基因表达,从而增强力学性能的改善。
注射生长因子的生物学方法也得到了研究。在这方面,Hildebrand 等通过兔模型发现,6 周时血小板源性生长因子BB 改善了MCL 的机械和生物学愈合。在机械方面,血小板衍生生长因子BB组表现出更大的极限负荷、能量吸收值及极限延长值。最近Yoshioka 等[88] 检测了注射富含生长因子的血浆对兔MCL 愈合模型的影响,发现可刺激成纤维细胞增殖及神经血管形成,与未治疗的对照组相比,愈合的MCL 具有明显更好的结构性能。
与MCL 相比,针对外侧副韧带的组织工程研究相对较少。然而,上文讨论过的ACL 和MCL 的基本原则和概念仍然适用于外侧副韧带和其他常受伤的膝关节韧带。应强调的是,这些方法的临床应用仍处于起步阶段。
局限性
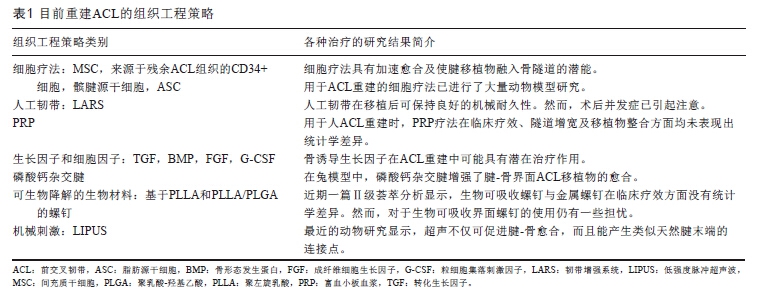
表1 总结了目前用于重建膝关节韧带的组织工程策略。随着研究的深入,采用适当的组织工程策略重建膝关节韧带,有望避免目前自体和异体移植技术的缺点,同时迅捷的功能性韧带化可以使患者快速恢复体育活动功能。然而,尽管具有上述优点,组织工程疗法的使用仍然缺乏有力的临床支持。在推断新疗法的潜在获益与安全性时,必须考虑到目前研究数量较少、样本量较小以及证据水平较低的现实。此外,促进韧带成功发育和修复的精确局部条件及机制尚有待阐明。还需要开展更多高质量、长期随访的随机临床试验,才能在韧带损伤治疗中确立可靠、有效且安全的新型组织工程方法。
结论
基于组织工程的韧带重建策略仍在持续发展。本文综述了该领域不断涌现的新研究。虽然我们仍处于骨科再生医学时代的起步期,但是针对这些新疗法的临床前研究正不断取得令人兴奋的成果。不过,仍需要开展精心设计的高质量对比临床研究,以便为进一步临床转化奠定基础。随着采用组织工程方法构建的下一代产品的逐渐临近,将需要采取纳入肌肉骨骼研究者及外科医师的多学科协作方法,以确定评估临床结局的合理方式。
参考文献请点击:组织工程化技术在韧带重建中的应用





 京公网安备11010502051256号
京公网安备11010502051256号