腰椎间盘退变模型的设计
2014-08-05 文章来源:湖南省人民医院骨科 李晓声,陈铁柱,曾焱 我要说
摘要: 目的 建立一种兔腰椎间盘突出症的动物模型。方法 动物随机分为实验组、对照组,每组10只,实验组将0.2ml无菌0.9%氯化钠溶液缓慢注入 L4-5椎间盘内。对照组椎间盘不穿刺注入,分别于造模后第2、4、8周进行X线检查后处死,从解剖形态、X线片、组织学观察椎间盘退变。结果 该方法能使椎间盘质地变硬、椎间盘周缘骨赘形成、椎间隙变窄、纤维环纤维排列散乱、髓核消失,2~8周观察: 解剖形态: 被注射椎间盘质地逐渐变硬,椎间盘突向椎管内压迫硬脊膜,脊神经根有黏连,分离困难。椎间盘周缘可见局部骨赘形成,质硬;X线片: 腰椎间隙逐渐变窄,骨赘形成,椎间孔狭小;组织学: 纤维环逐渐变薄,部分区域纤维层排列散乱,髓核消失,被增生的类骨质、骨质取代。结论 选用家兔在直视下行椎间盘内注射0.9%氯化钠溶液的方法,可成功制备腰椎间盘退变模型。
关键词: 椎间盘退变;动物模型;0.9%氯化钠溶液;兔
腰椎间盘突出症是引起腰背疼痛的主要原因,临床发病率高,近年来该病呈年轻化趋势发展,严重影响人们的生活及工作。该病发病机制尚未完全清楚,相关研究表明椎间盘退变是其主要原因[1]。为了研究椎间盘退变的机理以及为临床治疗椎间盘突出提供试验指导,学者们建立了大量动物模型,其中以针刺法最常用。本实验将针刺法进行改良,以7号腰穿针穿刺兔椎间盘,并注射0.2ml0.9%氯化钠溶液制备兔腰椎间盘退变模型。
1 资料与方法
1.1 实验动物 同种、体健家兔20只,年龄0.5~1.0岁,体重2.5~3.0kg。由长沙市东创实验动物科技服务部提供,饲养于湖南省人民医院临床研究所清洁级动物实验室。实验前分笼喂养 2周,以观察健康状况。动物房实行7:00~19:00光暗交替,相对湿度40%~70%,温度8~29℃。
1.2 实验方法 受赵定麟方法[2]启示,动物随机分为实验组和对照组,每组10只,用10%水合氯醛3ml/kg腹腔注射麻醉。仰卧位固定,左下腹部剃毛清洗后,常规消毒铺无菌孔巾。取左下腹纵切口,长约7cm,经腹膜外达腰椎前筋膜。钝性剥离显露L4S1前方椎体及椎间盘。确定 L4~5椎间盘后,实验组取7号腰穿针将0.2ml无菌0.9%氯化钠溶液缓慢注入椎间盘内,深度为0.5cm,相当于髓核部位。对照组不予以椎间盘穿刺注水,其余步骤同前。逐层缝合伤口,术后分笼自由活动。术后3d给予青霉素肌注,8万U/d。
1.3 解剖观察 分别于造模手术后第2、4、8周末,耳缘静脉注射空气10ml,各组随机处死 3只解剖观察。每组10只,剩余1只替补两组试验动物意外死亡。如两组均无死亡,第8周处理4只试验动物。
1.4 X线片检查 分别于造模后第2、4、8周,各组随机选出3只予以拍摄腰椎X线片。
1.5 组织形态学检查 造模手术后各组第2、4、8周,耳缘静脉注射空气10ml,各周随机处死3只,取其L4-5椎间盘,行石蜡切片及HE染色后,光镜下观察各时期椎间盘组织形态。
2 结 果
2.1 解剖学观察结果 对照组: 该组各时期椎间盘周缘与毗邻组织无黏连,椎管内无渗血,椎间盘触之质韧。实验组:术后2周: 被注射椎间盘周缘与毗邻组织有黏连,椎间盘触之稍质硬;术后4周: 被注射椎间盘周缘与毗邻组织黏连紧密,不易分离,椎间盘硬度增加(见图 1);术后8周: 被注射椎间盘成骨样硬(7号腰穿针难以刺入) ,椎间盘突向椎管内压迫硬脊膜,脊神经根有黏连,分离困难。椎间盘周缘可见局部骨赘形成,质硬(见图 2) 。
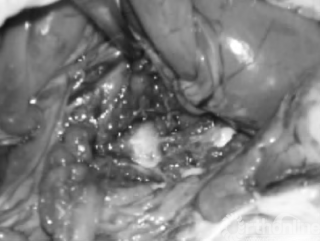
图1 实验组术后第4周肉眼观察,被注射椎间盘周缘与毗邻组织粘连紧密,不易分离,椎间盘硬度增加
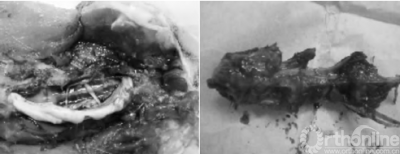
图2 试验组术后第8周肉眼观察,被注射椎间盘成骨样硬,间盘突向椎管内压迫硬脊膜,脊神经根有黏连,分离困难。椎间盘周缘课件局部骨赘形成,质硬
2.2 X线片试验结果
2.2.1 对照组 各期拍片示腰椎间隙正常,椎体边缘无骨赘形成,椎体骨质密度无明显改变。
2.2.2 实验组 术后2周: 注射后的腰椎间隙尚正常,椎体边缘椎间隙部位可见局部密度增高影,椎间孔尚无明显狭窄;术后4周: 注射后的腰椎间隙可见变窄,椎体边缘椎间隙部位骨赘形成,椎间孔可见狭窄改变;术后8周: 注射后的腰椎间隙明显变窄,甚至消失。椎间盘毗邻椎体边缘骨质密度增高,骨赘形成,椎间孔狭小。
2.3 组织学观察结果
2.3.1 对照组 对照组第2、4、8周末,每周随机处死3只,取其L4~5椎间盘,各时期椎间盘组织学无明显变化。椎间盘由外周的纤维环及中央的髓核组成。纤维环的外1/3主要是纤维组织,其间含有成纤维样细胞,并与椎体的软骨层相连,其间可见有少量的骨小梁; 内2/3则为纤维软骨。椎间盘的纤维排列与人体结构大致相似( 见图3) 。

图3 对照组光镜下显示椎间盘形态规则,纤维环排列规整,髓核明显(×40)
2.3.2 实验组 术后2周: 椎间盘形态规则,纤维层宽厚,排列规整,髓核明显,椎间盘后缘已开始出现透明软骨的类骨质。术后4周: 总体变化与前者相似,明显变化是可见纤维组织坏死,被增生的骨质取代( 见图4)。术后8周: 椎间盘病理改变明显,纤维环仅存于椎间盘边缘,很薄,部分区域纤维层排列散乱,趋向于退变、坏死,髓核消失,被增生的类骨质"骨质取代。有大片透明软骨和几个骨质增生区。增生的骨质区域已形成骨髓腔,内有骨髓组织( 见图5)。

图4 试验组术后4周,可见纤维组织坏死,被增生的骨质取代(×40)
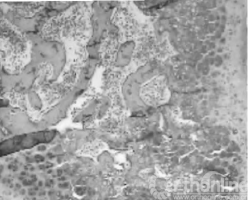
图5 试验组术后8周髓核消失,被增生的类骨、骨质取代(×40)
3 讨论
3.1 实验动物选择 腰椎间盘退变是引起腰腿痛的一个主要因素。构建腰椎间盘退变模型是研究椎间盘退变的病因和病理生理的基础。良好的椎间盘退变模型需要符合椎间盘退变的规律,所选动物解剖和生理特点尽可能与人类接近,模型重复性好。灵长类解剖生理与人类最为相近,是动物模型最理想的选择,但由于经济等原因受到限制,Elliott等[3]发现四肢动物椎间盘特性与人类相似,椎体长轴受力,认为四肢动物可用于椎间盘退变模型的制备。目前多选用鼠、兔、犬、羊等动物。本实验选用兔为模型动物主要考虑兔椎间盘大小合适,采用针刺法易于制作模型,其髓核和纤维细胞形态改变同人类变化相似,但其退变程度不如人类明显。虽然两者存在物种上的差异,但可作为研究椎间盘退变的实验模型。根据本实验观察,造模后实验兔的腰椎间盘病理性退变与人类相似,基本符合椎间盘退变的模型要求。
3.2 实验方法选择 目前建立腰椎间盘退变动物模型主要通过物理、生化的方式改变脊椎生物力学结构或椎间盘及髓核组织化学构成,促使椎间盘出现自发退变,包括改变脊柱负荷或活动、损伤纤维环、破坏脊柱稳定性、酶类/非酶类化学模型以及自发性退变模型,其中以针刺法损伤纤维环最常用[4-6],该法微创操作简便、经济、见效迅速。本实验采用针刺法,为确保针刺损伤纤维环,定位准确,予以经腹膜后直视下经棘旁穿刺造模。本次实验较顺利,经解剖观察、X 线片、组织切片观察,说明椎间盘退变符合实验造模要求。
3.3 实验造模的机理 椎间盘退变的原因众多,研究认为椎间盘退变主要与椎间盘生物力学改变、生活习惯、职业、外伤、细胞因子、炎症介质、营养代谢障碍、细胞凋亡、缺血缺氧等相关因素有关。腰椎间盘退变的发生与发展是人体在生长发育停止后开始,多于23岁后开始,纤维环与髓核相继退变,髓核表现为脱水及吸水功能减退,以致体积减小,弹性降低。在椎间盘内压力改变时致使压力分布不均,导致软骨终板变形损伤,影响椎间盘营养改变,椎间盘组织细胞成分改变等加速椎间盘退变。本实验造模用注射的方法既可增加局部间隙压力,又能避免对机体不必要的影响,减少椎间盘退变其他因素影响。
腰椎X线片显示椎间隙变窄主要是因为椎间盘内容脱出及退行性变所致; 在病变邻近的椎间盘纤维环呈线状钙化,可为确诊椎间盘纤维环破裂的直接X线象。手术造模2个月后的兔腰椎X线片显示椎间隙变窄,骨赘形成,椎间隙内线状钙化等征象,可基本判定注射后的椎间盘退变,纤维环破坏以及骨化与人的腰椎间盘退变X线片征象具有一致性。肉眼观察到椎间盘与毗邻组织黏连,向椎管内突出并与神经根有黏连等,符合腰椎间盘退变的病理过程。镜下观察从术后2周至8周的椎间盘组织切片,大体反映了注射0.9%氯化钠溶液后椎间盘退变的基本过程。此退变过程结合肉眼观察和X线征象,表明本实验建立的腰椎间盘退变模型具备形态学改变基础,模型是可靠的。
综上所述,选用家兔在直视下行椎间盘内注射0.9%氯化钠溶液的方法,经解剖观察、X线片、组织切片观察,椎间盘退变符合实验造模要求。能再现椎间盘退行性变的客观规律,动物模型制作相对简便,从而模型重复性好;所选动物——兔作为常见的实验动物,椎间盘结构与人类基本相同,具有经济性和便利性等优点,为研究腰椎间盘退变提供了一种合适的动物模型。
参考文献:
[1] Masuda K,Aota Y,Muehleman C,et al.A Novel rabbit model of mild,reproducible disc degeneration by anulus needle puncture:correlation between the degree of disc Injury and radiological and histological appearances of disc degeneration[J].Spine,2005,30(1):5-14.
[2] 赵定麟,陈德玉,沈强,等.实验性颈椎病模型的设计[J]. 中华外科杂志,1993,31(8):453-455.
[3] Elliott DM,Sarver JJ.Young investigator award winner:validation of the mouse and rat disc as mechanical models of the human luman lumbar disc[J].Spine,2004,29(7):713-722.
[4] Zhang H,La Marca F,Hollister SJ,et al.Developing consistently reproducible intervertebral disc degeneration at rat caudal spine by using needle puncture[J].J Neurosurg Spine,2009,10(6):522-530.
[5] Zhang KB,Zheng ZM,Liu H,et al.The effects of punctured nucleus pulposus on lumbar radicular pain in rats:a behavioral and immunohistochemical study[J].J Neurosurg Spine,2009,11(4):492-500.
[6] Ragab AA,Woodall JW Jr,Tucci MA,et al.A preliminary report on the effects of sustained administration of corticosteroid on traumatizaed disc using the adult male rat model[J].J Spinal Disord Tech,2009,22(7):473-478.





 京公网安备11010502051256号
京公网安备11010502051256号