2023盘点|中国骨关节炎研究年度进展
2024-02-26 文章来源:中南大学湘雅医院 作者:雷光华 曾超 我要说
2023盘点|中国骨关节炎研究年度进展
作者:雷光华 曾超
来源:中南大学湘雅医院
骨关节炎(Osteoarthritis,OA)是最常见的骨关节退行性疾病,导致关节疼痛、活动障碍,致残率高,疾病负担沉重。因其危险因素不清、治疗靶点不明,OA的精准防治一直是领域内全球研究重点与难点。过去一年我国在OA领域产出了众多高质量研究成果,我们基于PubMed网站对2023年OA领域发表的文献进行检索,限定国内机构为第一单位、标题出现OA关键词以及IF≥10的研究论文,共70篇。本文将从临床研究、基础研究、材料研究三大块进行分类总结,以期为广大同道提供借鉴和参考。
一、临床研究
2023年国内OA领域以第一单位共发表8篇IF≥10的临床研究,论文信息详见表1。南方医科大学珠江医院、香港中文大学赛马会公共卫生及基层医疗学院和华南理工大学广州市第一人民医院研究团队基于OA全基因组与蛋白质组数据统计值,采用孟德尔随机化研究设计,发现体循环中12种蛋白与OA存在潜在因果关联,为揭示OA的危险因素与潜在靶点提供了重要线索[1]。
中南大学湘雅医院骨科团队基于自主建立的自然人群队列“Xiangya Osteoarthritis Study”中的微生物组与代谢组数据,明确了肠道菌群失调介导的色氨酸代谢紊乱与手OA患病相关,并在独立队列“Xiangya Step Study”中验证了该发现,提示色氨酸代谢紊乱是手OA患病的危险因素,为疾病早期预防提供了理论依据[2]。而后,该团队再次基于“Xiangya Osteoarthritis Study”发现并验证了铁死亡相关基因(FTH1)在手OA发病机制中的作用,提示铁死亡可能参与手OA的发生发展[3]。此外,南方医科大学珠江医院研究团队通过对45项随机对照试验进行荟萃分析,发现相比透明质酸治疗,富血小板血浆治疗在缓解OA患者疼痛与改善功能方面更有效[4]。
中南大学湘雅医院骨科团队通过对152项随机对照试验进行网状荟萃分析,证实了运动疗法与OA常用口服镇痛药(非甾体类抗炎药和扑热息痛)的疗效无显著差异,结合其优越的安全性,提出运动疗法是一种治疗OA的“良药”,尤其适用于存在口服镇痛药禁忌证的患者[5]。江汉大学武汉市第五医院和广东医科大学附属医院研究团队通过对6篇随机对照试验进行荟萃分析,发现水疗可有效缓解膝关节疼痛[6]。
上海交通大学附属第六人民医院骨科团队通过队列研究发现,胰高血糖素样肽-1受体激动剂(Glucagon-like Peptide-1RA, GLP-1RA)可通过减重有效改善膝OA患者症状并减少膝关节手术率[7]。这些研究发现对OA临床治疗具有重要参考价值。此外,中南大学湘雅医院骨科团队采用模拟随机对照试验方法,发现通过服用减肥药物减轻体重,可有效降低超重或肥胖OA患者的全因死亡率,并对高血压、2型糖尿病和静脉血栓栓塞症具有保护作用,该研究发现为超重或肥胖的OA患者改善疾病预后提供了理论依据[8]。
二、基础研究
2023年国内OA领域以第一单位共发表19篇IF≥10的基础研究,限于篇幅,本部分仅回顾其中IF≥15的研究,所有论文信息详见表2。浙江大学干细胞与再生医学研究中心与浙江大学医学院附属第二医院骨科团队通过纳米分析技术剖析了OA进展中软骨结构、成分和机械特性,揭示了OA进程中关节面软骨“自上而下”渐变式钙化、骨软骨交界处“自下而上”跳跃式钙化的组织学特点,最终形成“骨-软骨-钙化软骨”的三明治特征结构[9]。
暨南大学再生医学教育部重点实验室研究团队发现,成纤维样滑膜细胞糖酵解增加是糖尿病OA(Diabetic Osteoarthritis,DOA)患者滑膜巨噬细胞浸润和M1极化的关键驱动因素,Yes相关蛋白1(Yes-associated Protein 1,YAP1)/硫氧还蛋白相互作用蛋白(Thioredoxin-interacting Protein,TXNIP)信号轴被证明在调节成纤维样滑膜细胞葡萄糖转运蛋白1(Glucose Transporter 1,GLUT1)依赖性糖酵解中发挥至关重要的作用,调节YAP1/TXNIP信号轴可抑制滑膜糖酵解和M1型巨噬细胞浸润,改善DOA进程[10]。
苏州大学附属第一医院骨科研究团队基于中度/重度OA患者软骨与IL-1β造模/非造模小鼠软骨转录组差异,结合多种体内外模型验证,筛选出OA发病机制中的关键蛋白——组蛋白去乙酰化酶(Silent Mating Type Information Regulation 2 Homolog 3,SIRT3)。团队通过敲除小鼠SIRT3,发现SIRT3缺失加重创伤后小鼠全关节退变,并通过结合蛋白组学分析等进一步明确SIRT3可使细胞色素C氧化酶亚基Ⅳ亚型2(Cytochrome Coxidase Subunit 4 Isoform 2, COX4I2)去乙酰化,从而增强细胞有氧呼吸,改善线粒体功能,反之激活SIRT3可恢复软骨代谢平衡,延缓小鼠创伤后OA的进展[11]。
第四军医大学附属唐都医院口腔科团队基于一种在骨软骨连接处神经血管化增强的小鼠OA模型发现,细胞外RNA含量在神经血管化OA关节中增加,并与病变程度及血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)的表达水平呈正相关。RNA-VEGF复合物可促进内皮祖细胞和三叉神经节细胞迁移和功能发挥,而降低RNA-VEGF复合物活性可抑制小鼠颞下颌关节过度神经血管化和骨软骨退化[12]。
南方医科大学珠江医院临床研究中心团队通过体内外实验证实髌骨下脂肪垫组织来源的细胞外小囊泡(Infrapatellar Fat Pad Tissue-derived Small Extracellular Vesicles,IPFP-sEVs)促进软骨细胞外基质分解代谢并诱导细胞衰老。该研究发现IPFP-sEVs富集并递送miRNA let-7b-5p和let-7c-5p至关节软骨细胞,靶向抑制层粘连蛋白B受体(Lamin B Receptor,LBR),介导软骨细胞代谢紊乱和细胞衰老[13]。
三、材料研究
2023年国内OA领域以第一单位共发表43篇IF≥10的材料研究,限于篇幅,本部分仅回顾其中IF≥15的研究,所有论文信息详见表3。四川大学高分子材料工程国家重点实验室研究团队自主设计了可同时模拟抗氧化酶和透明质酸合成酶活性的新型纳米酶,该纳米酶通过清除关节内活性氧/活性氮、促进透明质酸合成从而延缓OA模型鼠的软骨退变[14]。重庆医科大学附属第一医院与上海交通大学附属瑞金医院骨科团队构建了具有募集、捕获和重新编程巨噬细胞功能的新型微球,有效抑制OA关节炎症[15]。中国科学院深圳先进技术学院研究团队采用外泌体递送miR-204至软骨细胞,首次发现miR-204可通过抑制SP1-LRP1信号通路阻断关节内神经-软骨相互作用从而缓解OA疼痛[16]。
四川大学国家生物医学材料工程技术研究中心研究团队采用软骨细胞靶向肽修饰脐带间充质干细胞衍生的外泌体,并将其封装在巯基化透明质酸微凝胶中从而形成“两步”释药系统,该复合体系通过调控衰老软骨细胞表型延缓OA软骨退变[17]。香港中文大学医学院矫形外科及创伤学系研究团队证实了髌下脂肪垫来源的骨桥蛋白及整合素β3与OA病情进展密切相关,并基于此研发了载siRNA cd61的骨桥蛋白受体靶向纳米凝胶,可长效安全延缓OA病情进展[18]。海军军医大学长征医院与上海交通大学附属瑞金医院骨科团队共同构建了载硒掺杂碳量子点的水凝胶微球,证实其具有清除单核巨噬细胞线粒体活性氧和调节软骨-骨代谢平衡的功能[19]。
上海长征医院、中国人民解放军总医院、山东大学齐鲁医学院和山东第一医科大学研究团队采用表没食子儿茶素没食子酸酯合成了多酚类纳米药物,在OA模型鼠上明确了该纳米药物的有效性[20]。北京大学深圳医院和上海交通大学骨科材料创新与组织再生工程技术研究中心团队将外源性miR-223导入经II型胶原靶向肽修饰的人脐带间充质干细胞的细胞外囊泡,并证实其可有效抑制软骨细胞的NLRP3炎症小体激活和细胞焦亡[21]。上海大学联合同济大学附属上海第十人民医院骨科团队首次发现黑磷纳米片可同时改善OA软骨退变和软骨下骨病变[22]。
南方医科大学和南方科技大学研究团队首次制备了具有良好润滑性能的玉米蛋白@海藻酸盐/锶@骨化三醇纳米球,并探索其用于OA治疗的效果和安全性[23]。北京大学深圳医院骨科团队开发了一种载特立帕肽的脂质体-水凝胶复合体系,该复合体系有效改善了OA模型鼠的关节功能[24]。山东大学晶体材料国家重点实验室研究团队制备了一种具有类超氧化物歧化酶和过氧化氢酶功能的四氧化三锰纳米酶,并将其与硫酸软骨素水凝胶复合构建关节腔注射缓释递药系统,用于早期关节炎的局部缓释给药[25]。
中国科学院大学与首都医科大学研究团队联合开发了一种可同时实施针灸和药物递送的纳米药物递送针灸技术用于OA治疗[26]。南华大学附属第一医院和北京大学人民医院骨科团队以虾青素、1,2,4,5-环己烷四甲酸二酐等为原料,自主合成了一种载雷帕霉素的活性氧响应性纳米粒,该纳米粒通过降低细胞内活性氧水平和调节线粒体功能从而调节巨噬细胞极化,为OA的精准治疗提供了新策略[27]。南京大学鼓楼医院骨科团队构建了一种磁力控制的芯片软骨培养平台,为OA相关研究提供了一种理想的体外模型[28]。同济大学附属上海市第四人民医院研究团队合成了兼具高磁响应与抗氧化性的纳米磁操纵子并采用间充质干细胞搭载该操纵子,使干细胞能快速响应时变磁场并在关节内原位组装形成细胞团簇从而加强细胞间通讯和互作,进而诱导软骨细胞分化,最终促进软骨再生[29]。
结语
当前,我国OA研究水平已经进入世界前列,展望未来,国内OA相关研究团队需要更多的联合攻关、协作创新,特别是开展更深层次、更宽领域的跨学科合作,力争将更多的研究成果转化应用于临床,为广大OA患者更好地解除病痛困扰。
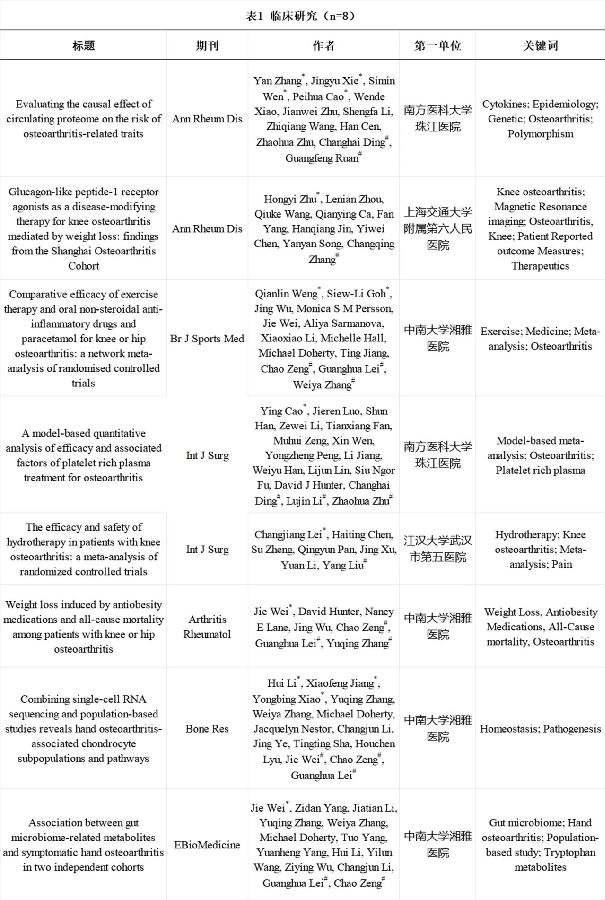
表1 临床研究(n=8)
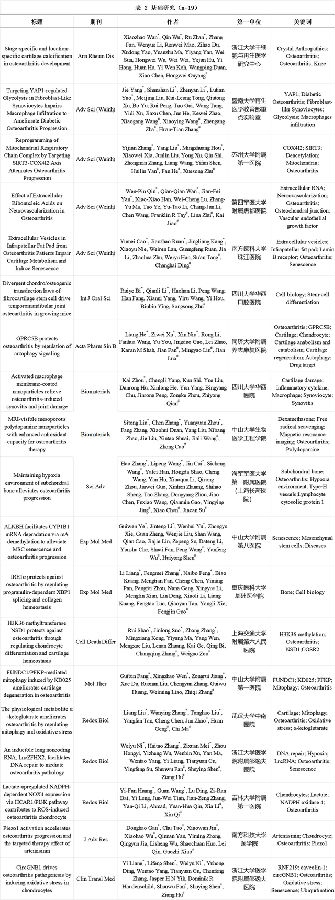
表2 基础研究(n=19)

表3 材料研究(n=43)
参考文献
[1]Zhang Y, Xie J, Wen S, et al. Evaluating the causal effect of circulating proteome on the risk of osteoarthritis-related traits[J]. Ann Rheum Dis, 2023;82(12):1606-1617. DOI: 10.1136/ard-2023-224459.
[2]Wei J, Yang Z, Li J, et al. Association between gut microbiome-related metabolites and symptomatic hand osteoarthritis in two independent cohorts[J]. EBioMedicine, 2023;98:104892. DOI: 10.1016/j.ebiom.2023.104892.
[3]Li H, Jiang X, Xiao Y, et al. Combining single-cell RNA sequencing and population-based studies reveals hand osteoarthritis-associated chondrocyte subpopulations and pathways[J]. Bone Res, 2023;11(1):58. DOI: 10.1038/s41413-023-00292-7.
[4]Cao Y, Luo J, Han S, et al. A model-based quantitative analysis of efficacy and associated factors of platelet rich plasma treatment for osteoarthritis[J]. Int J Surg, 2023;109(6):1742-1752. DOI: 10.1097/js9.0000000000000337.
[5]Weng Q, Goh S L, Wu J, et al. Comparative efficacy of exercise therapy and oral non-steroidal anti-inflammatory drugs and paracetamol for knee or hip osteoarthritis: a network meta-analysis of randomised controlled trials[J]. Br J Sports Med, 2023;57(15):990-996. DOI: 10.1136/bjsports-2022-105898.
[6]Lei C, Chen H, Zheng S, et al. The efficacy and safety of hydrotherapy in patients with knee osteoarthritis: a meta-analysis of randomized controlled trials[J]. Int J Surg, 2023. DOI: 10.1097/js9.0000000000000962.
[7]Zhu H, Zhou L, Wang Q, et al. Glucagon-like peptide-1 receptor agonists as a disease-modifying therapy for knee osteoarthritis mediated by weight loss: findings from the Shanghai Osteoarthritis Cohort[J]. Ann Rheum Dis, 2023;82(9):1218-1226. DOI: 10.1136/ard-2023-223845.
[8]Wei J, Hunter D, Lane N E, et al. Weight Loss Induced by Antiobesity Medications and All-Cause Mortality Among Patients With Knee or Hip Osteoarthritis[J]. Arthritis Rheumatol, 2023. DOI: 10.1002/art.42754.
[9]Wang X, Wu Q, Zhang R, et al. Stage-specific and location-specific cartilage calcification in osteoarthritis development[J]. Ann Rheum Dis, 2023;82(3):393-402. DOI: 10.1136/ard-2022-222944.
[10]Yang J, Li S, Li Z, et al. Targeting YAP1-regulated Glycolysis in Fibroblast-Like Synoviocytes Impairs Macrophage Infiltration to Ameliorate Diabetic Osteoarthritis Progression[J]. Adv Sci (Weinh), 2023:e2304617. DOI: 10.1002/advs.202304617.
[11]XU W, XIAO Y, ZHAO M, et al. Effective Treatment of Knee Osteoarthritis Using a Nano-Enabled Drug Acupuncture Technology in Mice [J]. Adv Sci (Weinh), 2023, 10(28): e2302586.
[12]Zhang Y, Liu Y, Hou M, et al. Reprogramming of Mitochondrial Respiratory Chain Complex by Targeting SIRT3-COX4I2 Axis Attenuates Osteoarthritis Progression[J]. Adv Sci (Weinh), 2023;10(10):e2206144. DOI: 10.1002/advs.202206144.
[13]Qin W P, Wan Q Q, Yan J F, et al. Effect of Extracellular Ribonucleic Acids on Neurovascularization in Osteoarthritis[J]. Adv Sci (Weinh), 2023;10(26):e2301763. DOI: 10.1002/advs.202301763.
[14]Yu P, Li Y, Sun H, et al. Mimicking Antioxidases and Hyaluronan Synthase: A Zwitterionic Nanozyme for Photothermal Therapy of Osteoarthritis[J]. Adv Mater, 2023;35(44):e2303299. DOI: 10.1002/adma.202303299.
[15]Xiao P, Han X, Huang Y, et al. Reprogramming macrophages via immune cell mobilized hydrogel microspheres for osteoarthritis treatments[J]. Bioact Mater, 2024;32:242-259. DOI: 10.1016/j.bioactmat.2023.09.010.
[16]Lu K, Wang Q, Hao L, et al. miR-204 ameliorates osteoarthritis pain by inhibiting SP1-LRP1 signaling and blocking neuro-cartilage interaction[J]. Bioact Mater, 2023;26:425-436. DOI: 10.1016/j.bioactmat.2023.03.010.
[17]Cao H, Chen M, Cui X, et al. Cell-Free Osteoarthritis Treatment with Sustained-Release of Chondrocyte-Targeting Exosomes from Umbilical Cord-Derived Mesenchymal Stem Cells to Rejuvenate Aging Chondrocytes[J]. ACS Nano, 2023;17(14):13358-13376. DOI: 10.1021/acsnano.3c01612.
[18]Dai B, Zhu Y, Li X, et al. Blockage of Osteopontin-Integrin β3 Signaling in Infrapatellar Fat Pad Attenuates Osteoarthritis in Mice[J]. Adv Sci (Weinh), 2023;10(22):e2300897. DOI: 10.1002/advs.202300897.
[19]Zuo G, Zhuang P, Yang X, et al. Regulating Chondro-Bone Metabolism for Treatment of Osteoarthritis via High-Permeability Micro/Nano Hydrogel Microspheres[J]. Adv Sci (Weinh), 2023:e2305023. DOI: 10.1002/advs.202305023.
[20]Yu H, Song Z, Yu J, et al. Supramolecular self-assembly of EGCG-selenomethionine nanodrug for treating osteoarthritis[J]. Bioact Mater, 2024;32:164-176. DOI: 10.1016/j.bioactmat.2023.09.020.
[21]Liu W, Liu A, Li X, et al. Dual-engineered cartilage-targeting extracellular vesicles derived from mesenchymal stem cells enhance osteoarthritis treatment via miR-223/NLRP3/pyroptosis axis: Toward a precision therapy[J]. Bioact Mater, 2023;30:169-183. DOI: 10.1016/j.bioactmat.2023.06.012.
[22]Lu H, Wei J, Liu K, et al. Radical-Scavenging and Subchondral Bone-Regenerating Nanomedicine for Osteoarthritis Treatment[J]. ACS Nano, 2023;17(6):6131-6146. DOI: 10.1021/acsnano.3c01789.
[23]Xie C, Sun Q, Dong Y, et al. Calcitriol-Loaded Multifunctional Nanospheres with Superlubricity for Advanced Osteoarthritis Treatment[J]. ACS Nano, 2023;17(13):12842-12861. DOI: 10.1021/acsnano.3c04241.
[24]Li G, Liu S, Chen Y, et al. An injectable liposome-anchored teriparatide incorporated gallic acid-grafted gelatin hydrogel for osteoarthritis treatment[J]. Nat Commun, 2023;14(1):3159. DOI: 10.1038/s41467-023-38597-0.
[25]Wang W, Duan J, Ma W, et al. Trimanganese Tetroxide Nanozyme protects Cartilage against Degeneration by Reducing Oxidative Stress in Osteoarthritis[J]. Adv Sci (Weinh), 2023;10(17):e2205859. DOI: 10.1002/advs.202205859.
[26]Xu W, Xiao Y, Zhao M, et al. Effective Treatment of Knee Osteoarthritis Using a Nano-Enabled Drug Acupuncture Technology in Mice[J]. Adv Sci (Weinh), 2023;10(28):e2302586. DOI: 10.1002/advs.202302586.
[27]Li H, Yuan Y, Zhang L, et al. Reprogramming Macrophage Polarization, Depleting ROS by Astaxanthin and Thioketal-Containing Polymers Delivering Rapamycin for Osteoarthritis Treatment[J]. Adv Sci (Weinh), 2023:e2305363. DOI: 10.1002/advs.202305363.
[28]Liu H, Wu X, Liu R, et al. Cartilage-on-a-chip with magneto-mechanical transformation for osteoarthritis recruitment[J]. Bioact Mater, 2024;33:61-68. DOI: 10.1016/j.bioactmat.2023.10.030.
[29]Deng C, Li Z, Lu L, et al. Sophisticated Magneto-Mechanical Actuation Promotes In Situ Stem Cell Assembly and Chondrogenesis for Treating Osteoarthritis[J]. ACS Nano, 2023;17(21):21690-21707. DOI: 10.1021/acsnano.3c06909.
作者简介

雷光华,主任医师、教授、博士生/后导师,中南大学湘雅医院院长、国家老年疾病临床医学研究中心(湘雅医院)主任、老年骨关节疾病防治教育部重点实验室主任。国家万人计划领军人才、教育部长江学者特聘教授、科技部中青年科技创新领军人才、国家卫生健康突出贡献中青年专家、全国先进工作者。兼任中国医师协会骨科医师分会副会长兼骨关节炎学组组长、国际矫形与创伤外科学会中国部副主席、中华医学会运动医疗分会常委和湖南省医学会副会长兼骨科学专业委员会主任委员等职。带领团队一直致力于骨关节退行性疾病的危险因素、发病机理、临床防治与转化医学研究,取得了一系列原创性成果。近年来主持国家重点研发计划项目、国自重点项目和国自区域创新发展联合基金等8项国家级项目课题。以通讯作者在JAMA、BMJ、Ann Intern Med(2篇)、Ann Rheum Dis(3篇)、Arthritis Rheumatol(5篇)等国际知名期刊上接收发表SCI论文178篇,总IF 1803.3,其中28篇IF>10。主编中华医学会临床诊疗指南和专家共识5部。专利授权59项,发明专利21项,转化4项。以第一完成人获中华医学科技奖一等奖、教育部科技进步奖一等奖、华夏医学科技奖一等奖,获吴阶平医药创新奖、全国创新争先奖。

曾超,骨科教授、研究员、博士生导师,老年骨关节疾病防治教育部重点实验室常务副主任。国家万人计划青年拔尖人才、2023年全球前2%顶尖科学家、国家重点研发计划青年项目首席科学家、全国青年岗位能手、湖南省科技创新领军人才、湖南省卫生健康学科带头人。学术任职:中国医师协会骨科医师分会骨关节炎学组委员兼秘书、中国老年保健协会骨关节分会常务委员、湖南省医学会骨科学专业委员会创新与转化学组组长、中国医师协会骨科医师分会青年委员会膝关节学组委员、中国医师协会运动医学医师分会基础研究与创新转化专业学组委员。
致力于骨关节炎临床防治和转化医学研究,近五年以第一/通讯作者(含并列)在JAMA、Eur Heart J、Ann Rheum Dis、Br J Sports Med、ACS Nano、Arthritis Rheumatol等接收发表SCI论文35篇,其中20篇IF>10,总IF 544.2,均为国内第一单位。论文被N Engl J Med、Lancet、JAMA、BMJ等他引4,423次。研究成果65次被美国风湿病学会、欧洲抗风湿病联盟、德国疼痛学会、日本骨科协会、法国风湿病学会、中华医学会等11国/洲38部权威组织指南/共识采纳推荐。执笔编写中华医学会临床诊疗指南和专家共识4部。





 京公网安备11010502051256号
京公网安备11010502051256号