脊柱转移性肿瘤手术治疗专家共识
2023-08-18 点击量:3349 我要说
来源:《中国脊柱脊髓杂志》2023年第33卷第4期
通讯作者:董健 肖建如 刘忠军
随着肿瘤综合治疗技术的发展,各类恶性肿瘤患者的生存期延长,出现脊柱转移的可能性也增高,故脊柱转移性肿瘤患者的数量逐年增长[1~3]。部分脊柱转移性肿瘤患者可带瘤生存较长时间,中位生存期为12~20个月[4、5]。
但脊柱转移性肿瘤导致病理性骨折和脊髓压迫等骨相关事件(skeletal related events,SREs)会引起疼痛与神经功能障碍,严重影响患者的生活质量,甚至缩短患者寿命。因此对脊柱转移性肿瘤患者进行合理精准的手术治疗非常重要。
脊柱转移性肿瘤的手术治疗以姑息性干预为前提,旨在减轻疼痛、改善或维持神经功能、恢复脊柱的稳定、实现肿瘤的局部控制[6、7]。目前脊柱转移性肿瘤的手术治疗缺乏多中心研究。
为了规范和推广脊柱转移性肿瘤的手术治疗,使更多临床医师了解各治疗手段的理念,中国康复医学会脊柱脊髓专业委员会脊柱肿瘤研究学组委托董健教授组织,特邀请全国专家共同制定本共识。
本共识采用“共识会议法”制定,以文献资料和临床经验为基础,逐条讨论共识内容后再进行意见征询,总结形成共识,供从事脊柱转移性肿瘤诊疗的医务工作者在临床工作中参考和应用。
1. 术前评估
1.1 患者整体健康状况
患者的整体健康状况是术前评估的首要内容。脊柱转移性肿瘤属于肿瘤晚期,大部分患者在术前都有化疗、放疗、靶向治疗或糖皮质激素药物治疗史。这些治疗以及恶性肿瘤本身都可能会使患者处在营养不良的状态,影响患者的手术耐受力和效果。研究发现,高龄、肥胖、糖尿病、骨密度低、营养不良、应用糖皮质激素和骨髓抑制会影响手术效果[8]。
恶性肿瘤患者进行放化疗后还可能出现白细胞和血小板减少以及凝血功能障碍。血管内皮生长因子(vascular endothelial growth factor,VEGF)、表皮生长因子受体(epithelial growth factor receptor,EGFR)等为靶点的分子靶向药物也可能影响组织血供,延长手术切口的愈合时间[9]。一般健康的评估如 Karnofsky 评分,纳入脊柱转移性肿瘤的相关综合评价中,作为治疗决策的重要组成部分。
1.2 疼痛
疼痛是脊柱转移性肿瘤患者最常见的症状,常早于其他神经症状[10]。脊柱转移性肿瘤引起的疼痛分为三种:局限性疼痛、机械性疼痛和神经根性疼痛。局限性疼痛是由于肿瘤组织在脊柱骨组织中的生长导致骨膜受到牵拉、骨内压升高或者炎症反应所引起[11],这种疼痛多为钝痛、定位局限,活动后不加重,并且使用消炎镇痛药有效。
放疗可缩小肿瘤体积,因此对减轻此类疼痛较为有效。机械性疼痛往往非常剧烈且与活动有关,如患者从卧位到坐位或者站立位时疼痛加剧,弯腰时疼痛加重。出现机械性疼痛提示受损的椎体无法承受生理上的机械负荷,表明患者需要行椎体强化或者手术内固定治疗。神经根性疼痛是由于肿瘤组织卡压神经导致的,疼痛呈放射性、锐痛、持续性,改变体位有时可以缓解,不具有特异性。有效减少肿瘤组织的体积、减轻神经压迫后,疼痛多可缓解。
1.3 原发肿瘤的组织学类型
原发肿瘤的组织学类型对化疗的敏感性是制定治疗策略的重要依据[12]。因为化疗需要较长时间才能起效,有症状的患者可能无法耐受较长的治疗周期,化疗一般用于无症状或者症状轻微的患者。肿瘤组织对于放疗的敏感性也是制定手术方案的重要参考[13]。对于实体肿瘤,一般认为乳腺癌、前列腺癌、卵巢癌和神经内分泌肿瘤对放疗敏感,而肾癌、甲状腺癌、肝细胞癌、非小细胞肺癌、结肠癌和肉瘤对放疗不敏感[7]。
采用脊柱立体定向放疗(spinal stereotactic radiosurgery,SSRS)可以无视传统意义上的放疗敏感性,制定合理的手术方案将肿瘤组织和正常脊髓分开(分离手术,separation surgery)是进行SSRS治疗的重要前提[14]。
1.4 病灶穿刺活检
不同的肿瘤病理类型对于化疗、放疗、术前血管栓塞治疗的敏感程度影响整体治疗方案的制定。因此,对于既往无肿瘤病史、肿瘤原发灶不明、虽有原发肿瘤病史但原发肿瘤长期不活跃并出现新发脊柱转移的患者建议术前行CT引导下的穿刺活检术[15、16]。
对于既往有恶性肿瘤病史,就诊时已经出现全身多发转移的患者,此时再出现新发脊柱病变,在时间允许的条件下,也应行病灶活检。 原发肿瘤的诊断有非常明确的影像学证据,同时该患者脊柱转移性肿瘤手术指征也十分明确,肿瘤病理学证据不影响手术策略的情况下,可以不行术前活检。而对于神经症状进行性加重的患者,则应直接手术减压[17]。
为获得良好穿刺标本应注意以下几点:(1)结合PET-CT的结果,穿刺代谢活跃的病灶;(2)穿刺的过程中,通过调整透视球管的位置更好地显示穿刺路径;(3)使用专业的穿刺针;(4)必要时需要血管造影,避开重要血管或供瘤血管。
1.5 术前靶向治疗
靶向治疗在两个方面影响着外科手术的决策:
(1)患者的预后。有研究表明,即使同样病理类型的肿瘤,是否伴有基因突变也显著影响脊柱转移性肿瘤患者预后[18]。对EGFR突变阳性的非小细胞肺癌患者研究中发现,特罗凯+培美曲塞+顺铂反应良好的EGFR突变阳性非小细胞肺癌患者平均生存期较EGFR突变阴性患者延长2年,对于Ⅲb和Ⅳ期肺癌治疗的中位生存期为18.4个月[19]。地舒单抗可以减轻肿瘤骨破坏,延缓骨转移瘤进展,明显减少SREs发生率[20],与唑来膦酸相比,地舒单抗减低初次SREs的风险比为0.79~0.84[20]。
(2)分子靶向药物影响组织血供,推迟手术切口愈合。使用靶向药物治疗的患者如需手术治疗,术前应停药。停药时间多依据临床经验,需结合药物半衰期以及靶向药物的性质。如静脉使用的VEGF为靶点的分子靶向药物,给药间隔比较长,则停药的时间也比较长,一般为4周左右。如每日口服的EGFR类靶向药物,由于半衰期短,停药2周可考虑手术。由于目前治疗方案的复杂性,脊柱转移性肿瘤治疗应该是以外科医生为主导、多学科专家共同参与的多学科综合治疗协作(multidisciplinary team,MDT)模式,针对每个患者进行个性化治疗方案。
1.6 术前动脉栓塞
术前动脉栓塞术的目的是减少术中出血。同时可栓塞肿瘤组织血管,使肿瘤坏死溶解[21]。文献报道从2005~2017年术前栓塞手术量每年增长0.16%[22]。研究发现,富血供肿瘤如肾癌、甲状腺癌等,在术前栓塞后,术中的出血量以及输血量均可以显著减少,而乏血供肿瘤并不能从术前血管栓塞中获益[23、24]。
既往认为乏血供肿瘤,如乳腺癌、前列腺癌等,若术前影像检查(DSA、CT-DSA等)提示转移灶富血供,也可行动脉栓塞治疗[21]。但DSA选择性血管造影若显示呈“发卡状”脊髓前动脉,且与拟栓塞的椎体血管共干,此类血管在脊柱肿瘤血管栓塞术中禁忌栓塞。操作者应该充分掌握栓塞技术,并具有丰富的操作经验[25]。手术当天进行栓塞比术前1d栓塞可以更有效地减少术中失血,应尽量在栓塞术后24h内施行手术,最迟不晚于48h[26]。
2 评分系统
2.1 Tomita评分系统
2001年提出的Tomita评分是根据原发瘤的恶性程度、内脏转移及骨转移灶三项因素进行评估,每项分别为4、2、0分,分值越高,表示预后越差。该评分系统不仅能判定哪类患者可以手术,而且可以依据评分体系直接决定手术方式。
对于2~3分的患者行广泛切除(指在肿瘤假膜之外进行游离,切除的肿瘤附有一层连续的健康组织)或边缘切除(是指沿着肿瘤的假膜或反应组织进行游离整块切除),以获得长期局部控制;4~5分的患者行边缘或者病灶内切除(操作在瘤体内进行),以获得中期局部控制;6~7分的患者行姑息性手术;8~10分的患者仅非手术支持治疗[27]。
2.2 Tokuhashi修订评分系统
1990年,Tokuhashi等[28]对脊柱转移性肿瘤患者进行了综合评分,并根据评分结果指导治疗方案。2005年,Tokuhashi等[29]在原有评分系统的基础上制定了新的修订评分系统。目前Tokuhashi修订评分系统包括总体健康状况、脊柱外骨转移数目、椎体转移数目、主要脏器转移、原发肿瘤类型、脊髓损害程度6个方面。
全身情况(Karnofsky评分)分为差、一般或良好。脊柱外转移分为≥3个、1~2个或0个。椎体转移分为≥3个、2个或1个。脊髓损害情况分为完全型、部分型和无损害型。内脏转移灶根据是否可以手术切除进行评分,同时还需考虑原发肿瘤的组织学类型。每项指标匹配分数,最高得分为15分。总分0~8分、9~11分和12~15分预示着患者的预期生存时间分别为<6个月、6~12个月和>12个月。各学者对不同分值处理意见有较大分歧,国内学者多采取更积极的策略[30]。对于单发的、原发肿瘤恶性程度相对较低的脊柱转移性肿瘤,Tokuhashi修正评分12~15分者,采取积极的手术治疗可取得较好的疗效。
Tomita评分和Tokuhashi改良评分是目前临床上运用最广泛的评分系统,但也存在一定的缺陷。两套评分系统都未考虑脊柱力学的稳定性。评分系统中缺乏原发肿瘤对放化疗的敏感性[31、32]。对于不同肿瘤的基因型对预后也起到重要作用,例如,ER/HR(-)和三阴乳腺癌其恶性程度高于其他类型的乳腺癌,Wang等[33]的研究发现:ER/HR(-)和三阴乳腺癌患者应从Tokuhashi改良评分模型的5分下降到3分,从Tomita评分的慢性生长(1分)改为中速生长(2分)。
同时此两项评分都是10年前的评分,而近年来原发肿瘤靶向治疗已大大改善了脊柱转移性肿瘤患者的预后,文献报道两项评分的准确性有待进一步提高[34~36]。Lee等[34]回顾性研究发现Tokuhashi改良评分预测低估了患者实际的生存时间。Morgen等[35]回顾性研究了2321例脊柱转移性肿瘤患者,发现在2005~2010年这段时间内,肾癌和肺癌患者1年的生存率有明显的提高,其原因归结于靶向治疗。一项Meta分析指出,修订版Tokuhashi评分模型的准确性为63%,且准确性呈现逐年下降趋势[36]。
2.3 脊柱稳定性(spinal instability neoplastic score,SINS)评分系统
脊柱肿瘤研究协会(Spine Oncology Study Group,SOSG)将肿瘤相关脊柱不稳定义为“肿瘤造成脊柱结构不完整,产生相应的活动性疼痛、症状性或进行性畸形,及/或生理负荷下的神经损害”[37]。SOSG制定了一个评分系统,称为SINS评分系统[38]。目前,该系统单独将脊柱稳定性作为手术指征的评分。
SINS包含6个参数:病灶位置、疼痛、影像学脊柱序列、病灶性质、椎体塌陷以及是否涉及后柱结构。高SINS评分提示需要利用手术恢复脊柱的稳定,而低SINS评分(0~6)提示脊柱稳定,中度SINS评分(7~12)的脊柱肿瘤需要进一步讨论。是否需要实施手术最主要取决于医师自身的经验判断[39、40]。SINS评分可以作为独立的手术指征。SINS的可靠性研究显示,对于可能存在脊柱不稳定或已存在脊柱不稳的患者,SINS的敏感性、特异性可分别达到95.7%、79.5%,说明该评分体系在对脊柱肿瘤患者进行术前评估的过程中较为准确。
一项系统评价认为SINS评分具有良好的观察者内和观察者间的可靠性,尤其是在脊柱外科和骨肿瘤医师中[41]。该系统提高了对脊柱不稳的认识,可在脊柱转移性肿瘤患者出现神经功能障碍前提前识别脊柱不稳定,而且使脊柱外科、骨肿瘤科、肿瘤科、影像科等不同科室医师诊治脊柱转移性肿瘤有了共同的评估标准,增强各科室的交流和转诊[42]。SINS系统的局限性包括无法判断患者预后、已经手术的节段或者放化疗后的节段无法评估、过度依赖医生的经验[43]。
2.4 硬膜外脊髓受压(epidural spinal cord compression,ESCC)评分系统
SOSG对于硬膜外脊髓压迫程度进行了分级[44],依据压迫最严重部位的横断面MRI T2加权像上共分为6级:
0级,肿瘤局限于骨中;
1a级,肿瘤侵犯硬膜外腔,侵犯到硬脊膜但是硬膜囊无变形;
1b级,硬膜囊变形但未触及脊髓;
1c级,接触到脊髓但脊髓未受压;
2级,脊髓受压但脑脊液可见;
3级,脊髓受压且脑脊液不可见。
ESCC 0级的患者可考虑单纯放疗。分离手术加术后放疗是对于ESCC 2级和3级脊柱转移性肿瘤伴有硬膜外脊髓压迫的最佳治疗方案[45]。
3 脊柱转移性肿瘤的手术治疗
手术的主要目的是提高患者生活质量,包括:(1)缓解疼痛;(2)改善神经功能;(3)重建脊柱稳定;(4)控制肿瘤局部进展[7、46]。同时,手术治疗也为肿瘤的综合治疗提供了机会。
3.1 全脊椎整块切除术(total en bloc spondylectomy,TES)
由于脊柱手术显露困难,周围结构复杂,既往的手术大多采用瘤内刮除或逐片切除,局部复发率高达90%以上。为了降低肿瘤的局部复发率,有学者提出对脊柱肿瘤进行TES。以往的TES以前后联合入路为主,手术时间长、创伤大、风险高、出血多,制约了该手术在脊柱转移性肿瘤治疗中的应用。
近年来,随着脊柱外科技术的飞速发展,胸腰椎一期后路TES已经日益完善,手术创伤减小,并发症发生率降低,TES逐渐被用于脊柱转移性肿瘤治疗,成为控制肿瘤局部进展的重要手段。
目前,通过严格把握手术指征,选择合适的病例,TES能减少肿瘤局部复发,提高患者生活质量。TES的适应证为患者全身一般情况良好、预期寿命>6个月、Tomita分型2~5型、孤立性脊柱转移性肿瘤并且原发肿瘤病灶治疗有效[47]。同时需结合肿瘤的综合治疗、主刀医生团队的手术经验、手术创伤和并发症评估以及患者的经济情况等综合考虑。每例患者需要个体化评估,谨慎使用TES。
Tomita根据脊柱肿瘤局部侵犯的方式、受累的解剖部位将脊柱转移性肿瘤分为3类7型来选择符合TES切除的适应证[48]。对间室内病变的肿瘤(1~3型)应进行广泛切除或至少是边缘切除;对于间室外病变的肿瘤(4~6型),只有当病灶周围存在纤维反应带时才可能进行边缘切除。TES适用于2~5型,1型和6型属于相对适应证,而7型则属于禁忌证。
Boriani等[49]提出的WBB分期为脊柱转移性肿瘤的治疗奠定了理论基础。他在脊椎横断面上按顺时针方向将脊椎均分为12个扇形区域,从椎旁到椎管分为A~E共5个组织层次,其中前部结构为4~9区,后部结构为1~3区和10~12区。根据WBB分区,对于累及4~8区(或5~9区)的患者,肿瘤已累及一侧椎弓根者,术中通过肿瘤未累及侧的正常椎板及对侧椎弓根截骨达到肿瘤学意义上的全脊椎整块切除;若双侧椎弓根均有肿瘤累及,即WBB分区在4~9区的患者,只能做到解剖学意义上的全脊椎整块切除(当肿瘤病灶侵犯双侧椎弓根时,进行椎弓根截骨时不可避免地进入肿瘤,造成肿瘤细胞的污染,但椎弓根是连接椎体前后方的最狭窄部位,因此截骨量最小且肿瘤细胞的污染可降到最低,所以临床上均选择经双侧椎弓根截骨进行手术。该切除方式属于瘤内切除的范畴,是解剖学意义上全脊椎整块切除)。
3.2 分离手术
随着放疗技术的发展,立体定向放疗能够更好地控制肿瘤的恶化,尤其是对于传统放疗不敏感的肿瘤。最近的研究数据表明,无论肿瘤的组织学和体积如何,SSRS都能得到良好的临床疗效,限制肿瘤局部生长,从而避免损伤脊髓和相关的组织[50、51]。对脊柱转移性肿瘤进行SSRS治疗的前提是肿瘤组织和正常脊髓之间存在一定的空间距离,因此在这样的理念指导下,出现了分离手术。
分离手术是由美国纪念斯隆-凯特琳癌症中心(Memorial Sloan-Kettering Cancer Center,MSKCC)的Bilsky于2010年首先提出,主要是为了配合放疗手术(radiosurgery),定义为脊柱转移性肿瘤与硬膜分离,适用于脊柱转移性肿瘤侵及硬膜外腔,尤其适用于原发肿瘤对传统放疗不敏感且脊髓严重受压的患者[52]。
该治疗策略分两步:(1)通过后路切除椎板和关节突关节,环形切除硬脊膜周围2~3mm的肿瘤[53];(2)脊髓充分减压后,对脊柱转移性肿瘤进行高强度的精准放疗[46]。
手术并不追求完全切除脊髓周围肿瘤或椎体,根据脊柱稳定性情况行后方内固定。分离手术分离的神经和肿瘤之间的距离并非越大越好,并且在术后一定要配合定向放疗。其禁忌证为:(1)富血运肿瘤;(2)放疗敏感的肿瘤;(3)低级别ESCC。
3.3 后路椎板切除内固定术
后路椎板切除内固定术是指单纯从后路切除椎骨椎板、附件并辅以内固定,以达到脊髓减压的目的。适用于肿瘤只破坏后侧附件(WBB分区10-3区)的病例或拟行姑息减压手术的病例。身体无法耐受手术的情况亦视为禁忌。
3.4 经皮椎体成形术(percutaneous vertebroplasty,PVP)与经皮穿刺椎体后凸成形术 (percutaneous kyphoplasty,PKP)
PVP是在术中X-Ray透视的辅助下,利用穿刺针直接经皮穿刺,经椎弓根向椎体内注射骨水泥,通过骨水泥在固化过程中释放的热量使肿瘤组织坏死,同时毁损神经末梢,缓解疼痛。注入的骨水泥可以稳定椎体微骨折,以稳定加固椎体,防止椎体进一步塌陷。在此基础上的 PKP技术,在同样完成穿刺后,在注射骨水泥前,先将球囊样装置置入椎体,球囊膨胀后将压缩的终板抬高,纠正由于椎体压缩造成的脊柱后凸,随后撤除球囊注射骨水泥。
PVP和PKP术后的患者也需进一步放疗。这两种治疗方式的适应证为没有神经压迫、椎体后壁相对完整、椎弓根无肿瘤累及无严重椎体压缩的患者,对溶骨性骨转移肿瘤破坏椎体引起的剧烈疼痛以及椎体病理性压缩骨折进行姑息性治疗[54~56]。
禁忌证:(1)局部或全身感染;(2)椎体肿瘤压迫脊髓引起不全瘫;(3)有严重的凝血功能障碍;(4)已知对骨水泥主要成分聚甲基丙烯酸甲酯(polymethylmethacrylate,PMMA)过敏;(5)妊娠。
3.5 射频消融和微波消融
射频消融是指在影像系统的引导下,将射频电极探针定位于肿瘤组织,激发周围组织细胞进行等离子震荡产生较高的热量,形成一个高温区域,局部温度可达60~100℃,从而有效杀死局部肿瘤细胞,同时,肿瘤组织周围会形成反应带,切断肿瘤血供并防止肿瘤增大或转移。射频消融的适应证是对脊柱转移性肿瘤患者疼痛进行姑息治疗。
肿瘤距离脊髓1cm内为射频消融的禁忌。禁忌证还包括:(1)有严重的凝血功能障碍;(2)伴发感染;(3)重要脏器功能严重衰竭;(4)椎体破坏严重有截瘫危险。操作上要注意射频电极不能直接放在椎体后壁[57]。
射频消融联合骨水泥椎体成形能够很好地缓解疼痛,同时骨水泥成形可以恢复椎体高度,在一定程度上重建脊柱生物力学结构,缓解脊柱不稳导致的疼痛[58、59]。微波消融作为一种热疗技术,其利用恶性肿瘤细胞对高热敏感的特性,对骨内肿瘤细胞进行灭活,具有杀伤肿瘤细胞且不影响脊柱稳定性的优点。其杀伤肿瘤细胞的原理包括:细胞凝固性坏死、再灌注损伤以及激活免疫应答。
单独应用微波治疗仅适用于单纯局限于间室内的肿瘤(Tomita分型中1~3型),对于间室外的肿瘤治疗应考虑联合手术或放射治疗手段[60~62]。禁忌证包括:(1)严重的凝血功能障碍;(2)心脑血管疾病或者是肺功能障碍者。微波消融联合应用椎体成形术、分离手术等微创手术方式,可以达到灭活肿瘤组织、维持脊柱力学稳定性并减少手术创伤的目的,是一种安全、有效的姑息治疗方法[63、64]。
3.6 手术并发症及预防
文献报道脊柱转移性肿瘤手术的并发症发生率为10%~66.7%[65],其中手术部位感染 (surgical site infection,SSI)、内固定失败和出血是最常见并发症。脊柱转移性肿瘤手术SSI的发生率高达30%[65],较其他脊柱手术明显增高。脊柱转移性肿瘤术后再次手术的最常见原因是SSI[66]。营养不良、化疗和放疗暴露增加了脊柱转移性肿瘤手术患者SSI的风险[67]。外科医生应在围手术期提供足够的营养支持,并确保放疗和手术之间有足够的时间间隔,同时应考虑其他危险因素,例如吸烟、肥胖和内科合并症[68],以最大限度地减少SSI。
近年来,脊柱术后静脉血栓栓塞症(venous thromboembolism,VTE)越来越受到关注[69~71]。脊柱转移性肿瘤患者是VTE发生的高危人群。有研究报道脊柱转移性肿瘤患者围手术期深静脉血栓(deep vein thrombosis,DVT)的发生率为14.1%,有8%的患者在术前就发生DVT[72]。研究显示脊柱转移性肿瘤患者术后出现有症状性的VTE会明显降低患者术后1年的存活率[73]。在无出血风险的情况下,脊柱转移性肿瘤患者围手术期应采用联合的VTE预防措施[74]。
3.7 术后SSRS
SSRS能够更好地控制肿瘤的恶性进展,尤其是对于传统意义上放疗抵抗的肿瘤(例如肾癌、黑色素瘤、肉瘤等),同时可减少脊髓等正常组织的放射损伤。在放疗技术上,SSRS优于常规分割的调强放射治疗[75],在疼痛控制方面,单次大剂量的SSRS效果可与分次等同,但可能增加再次治疗的几率,其最佳剂量分割模式有待进一步前瞻性临床研究明确[76、77]。
单次大剂量的SSRS局部控制效果要优于分次的SSRS[78]。因此对于无明显脊柱不稳或无明显脊髓损害症状的患者可作为首选治疗方法[79、80]。对于已经出现病理性骨折或者濒临骨折的患者,不建议术前放疗,术前放疗也会增加切口并发症的发生率[81]。对于已经放疗的患者,手术和放疗的时间间隔应大于2周。
准备术后放疗的患者,建议在伤口愈合或间隔2 周后再进行放疗[82、83]。分离手术后的定向放射治疗必须在术后3~5周内进行,否则失去意义。术中放疗、放射性粒子植入都属于近距离放疗,由于目前对于脊柱转移性肿瘤的疗效临床循证证据不足,暂不写入本共识。
4 总结
脊柱转移性肿瘤患者手术治疗选择应根据综合情况决定,结合预期生存期、治疗目标与其相关医疗资源可及性和经济支撑能力,实行个体化原则。确定原发肿瘤的类型,评估患者的情况和预后,通过手术治疗解除神经压迫和恢复脊柱的稳定性,缓解患者症状,控制肿瘤局部的进展,并为后续的放疗和化疗提供条件。其诊疗流程见图1。
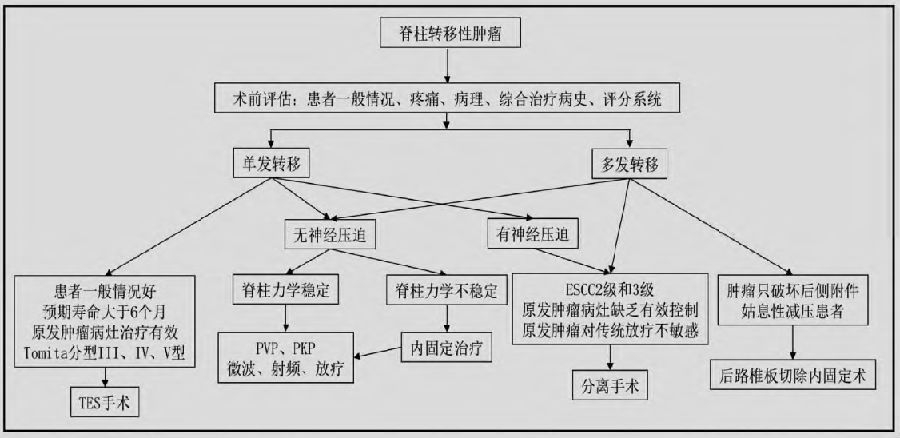
图1 脊柱转移性肿瘤诊疗流程图
共识制定专家

参考文献:









 京公网安备11010502051256号
京公网安备11010502051256号