骨肉瘤循环肿瘤DNA检测的建议及研究
2023-03-07 我要说
引文:
1.Pascual J, Attard G, Bidard FC, et al. ESMO recommendations on the use of circulating tumour DNA assays for patients with cancer: a report from the ESMO Precision Medicine Working Group. Ann Oncol. 2022 Aug;33(8):750-768. doi:10.1016/j.annonc.2022.05.520. Epub 2022 Jul 6. PMID: 35809752.
2.Lyskjaer, I., et al., Osteosarcoma: Novel prognostic biomarkers using circulating and cell-free tumour DNA. Eur J Cancer, 2022. 168: p. 1-11.
骨肉瘤的分子生物学检测不仅在传统的诊断和鉴别诊断中起着非常重要的作用,在临床治疗策略制定和肿瘤生物学行为预测等方面也具有重要的价值,是骨肉瘤诊断、治疗的重要组成部分。随着科技的发展,新的技术手段和检测方式层出不穷(荧光原位杂交、RT-PCR、二代测序等),推动了骨肉瘤的诊疗进程。
血浆进行的循环肿瘤DNA(ctDNA)检测正在迅速发展为用于癌症患者的强有力的证据基础。欧洲医学肿瘤学会(ESMO)召集了一个专家工作组,审查ctDNA检测的分析和临床有效性和实用性。
一、ctDNA分析的介绍和挑战
cfDNA(Circulating free DNA,循环游离DNA)和ctDNA (circulating tumour DNA,循环肿瘤DNA)是几种癌症类型的疾病监测和预测的有前途的生物标志物(其在肿瘤进程中的预测及应用价值如下图所示);然而,很少有关于OS相关(osteosarcoma,骨肉瘤)的研究报道。
英国皇家国立骨科医院针对此进行研究,其目的是发现和验证骨肉瘤的甲基化生物标志物,检测OS患者血浆ctDNA,并探索其作为预后标志物的效用。
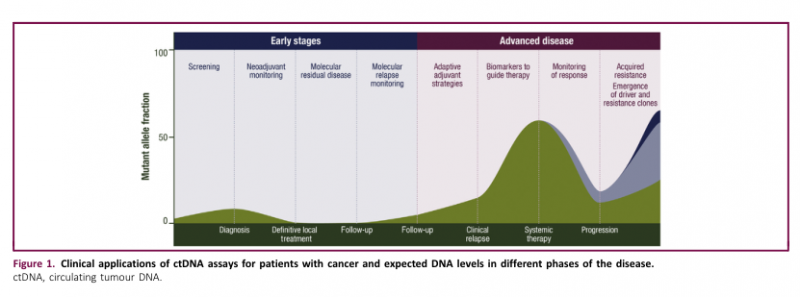
二、ctDNA应用于骨肉瘤效果评判的研究方法
以下为研究的流程:
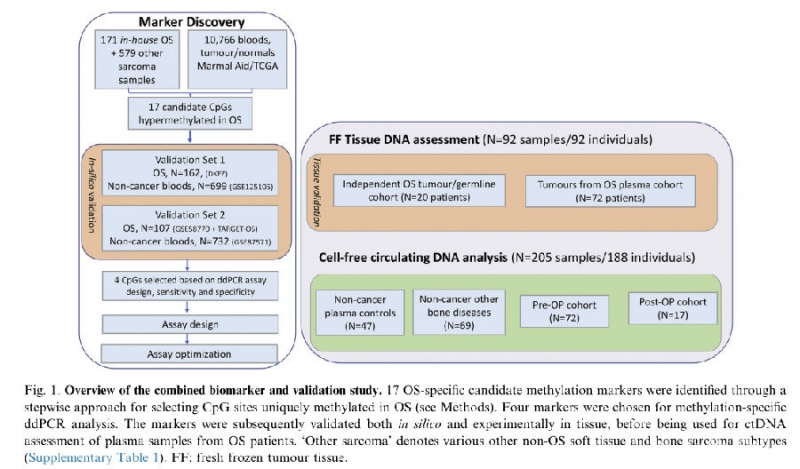
内部数据集包括750个不同肉瘤亚型的样本,外部数据集使用TCGA biolinks从Marmal-aid下载得到。验证集I包括来自德国海德堡162个OS的450K和EPIC甲基化原始IDAT文件。验证集II包括21个公开可用的GEO数据集的OS样本(GSE58770),另有86个来自TARGET-OS。
使用COHCAP.R对17个确定的候选甲基化标记(CpGs)进行注释。ddPCR(Methylation-specific digital droplet PCR,甲基化特异性数字液滴PCR)采用Primer3Plus和MethPrimer设计,并用BiSearch进行检测。使用pROC.R进行受试者工作特征(ROC)分析,以确定单个探针和联合探针(其中至少两个标记为阳性)的敏感性和特异性。
为了能够对可用血浆使用ddPCR检测,我们通过计算训练和验证集的敏感性和特异性将标记物的数量从17个减少到4个,并选择以下标记物进行实验验证:cg02169391、cg22082800、cg25680486和cg26100986。所有这些标记都位于7号染色体上。cg02169391位于MEST基因启动子中,其余CpGs位于前胶原PCOLCE基因内区域。
3个临床样本集被用于实验验证:
1) 来自20名患者的高级别骨肉瘤样本;
2) 来自47名健康志愿者(2.5mL血浆)的对照血浆样本和69名良性骨病和退行性关节疾病个体的4.5mL血浆;
3) 来自72例骨肉瘤患者的样本,包括血液或其术前、治疗前血浆样本,另外还有17个术后血浆样本(样本量为3-4.5mL,其中1-2mL用于ddPCR分析)。
三、结果
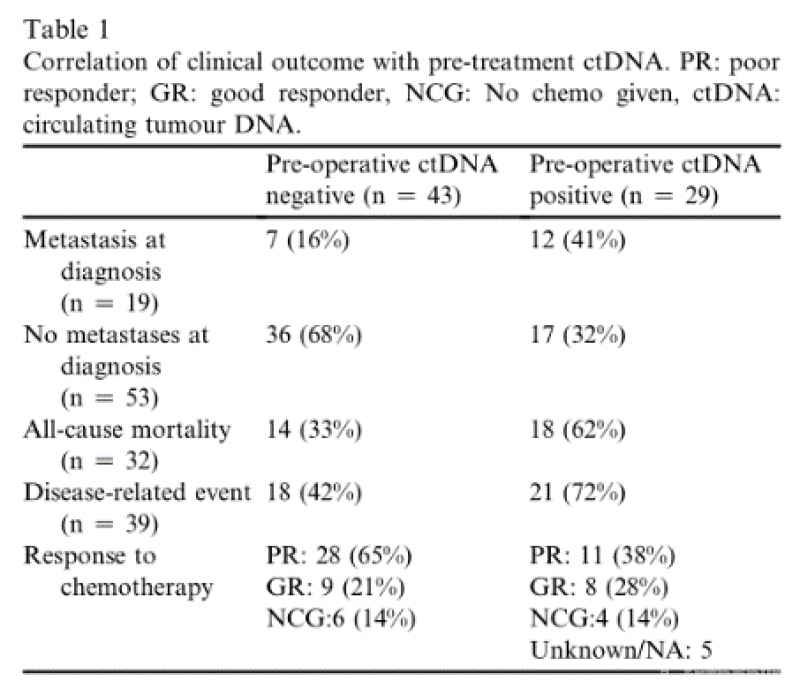
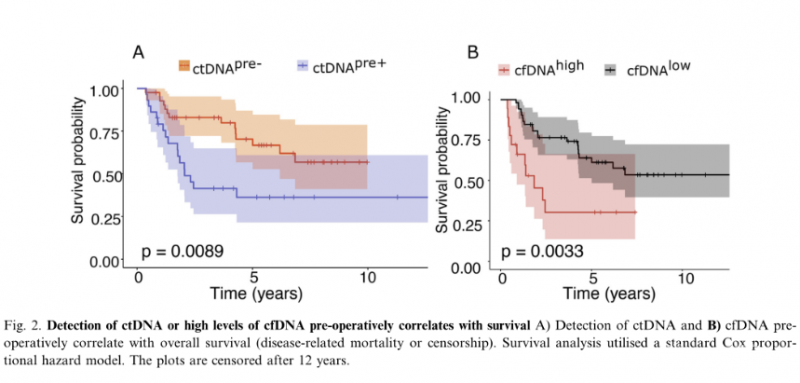
关于ctDNA在骨肉瘤中的应用在Table1和Figure2中呈现。ctDNA检测在骨肉瘤的管理中有许多潜在的应用,因此了解该检测方法的敏感性和特异性是重要的。
在17例出现临床局限性疾病的患者中,术前检测到ctDNA,其中10例随后发生了疾病相关事件,这一发现表明,液体活检有可能早期识别这些不良结果高风险的患者。虽然我们无法显示基于术前ctDNA检测的局部疾病队列在生存率上的统计学显著差异,但我们预计一个更大的验证队列将证明这一点。
ctDNA检测对监测也很有价值,特别是在缺乏组织样本的情况下,以及在临床试验环境中,为监测疾病对治疗的反应提供基线。这项研究虽然是迄今为止规模最大的,但在将研究结果转化为临床实践方面规模很小,因此需要在上述场景中进行验证。
四、设计和终点
ctDNA的临床应用依赖于具体情况,取决于疾病类型和阶段,可有效根除MRD的现有治疗方法和预期用途(例如,指导术后辅助治疗或遵循标准辅助治疗、监测)。
目前正在进行多个基于ctDNA的随机临床试验,以确定ctDNA在早期实体肿瘤中的临床效用。一般来说,ctDNA引导的试验可以在以下临床环境中进行(表3)。
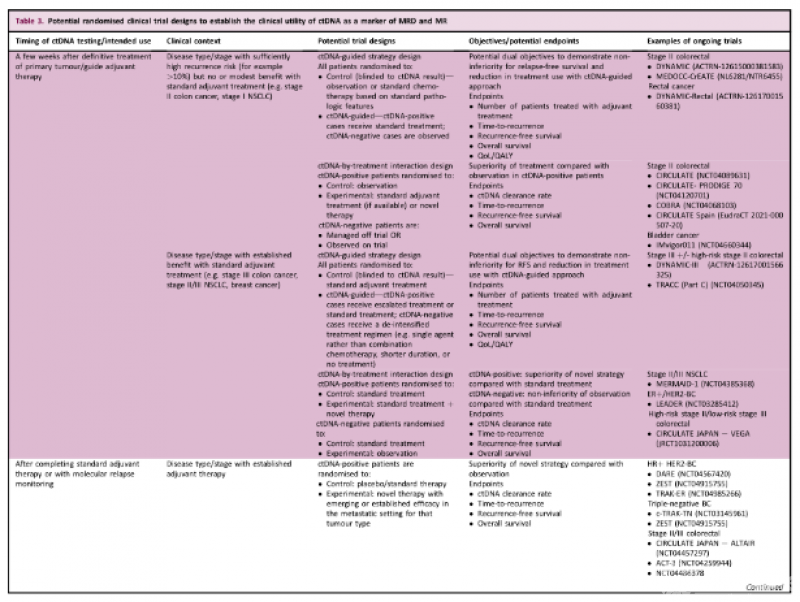
应确定治疗后几周:检验ctDNA检测是否可用于减轻ctDNA阴性患者的辅助治疗和/或增强/强化ctDNA阳性患者的治疗。非劣势(用于去强化策略)和优势(用于升级策略)设计都可以使用。
在完成标准辅助治疗后不久:主要目的是调查额外的“二线”或“后辅助”新疗法是否可以提高ctDNA可检测但影像学无疾病证据的患者的治愈率。
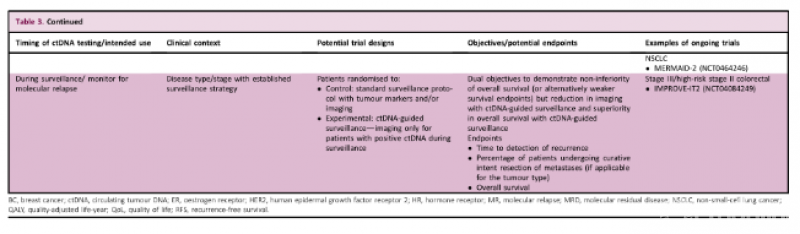
在监测过程中:确定ctDNA引导的监测与标准监测方案相比是否会导致更早发现复发,更多患者接受转移灶的治愈切除或生存率的提高。
除了术后分析外,ctDNA诊断分析的价值仍不确定。假设,在任何确定治疗(低脱落肿瘤)前排除ctDNA阴性的患者可能会降低确定治疗后假阴性结果的发生率。
ctDNA结果的周转时间也可能影响研究设计,特别是在术后即刻环境下,肿瘤学家通常渴望在术后4-6周开始辅助治疗。
五、总结
LBs(液体活检),特别是ctDNA检测,越来越多地应用于临床实践,已经有足够的证据证明晚期癌症基因分型的临床实用性,可以作为肿瘤引导策略的替代方案来指导治疗,特别是在组织活检不理想或时间至关重要的情况下。
在临床应用中必须考虑不完全敏感性,特别是对基因融合和拷贝数事件的较低敏感性。进一步的检测方法的发展将“真实的”从可能的“假的”阳性或阴性结果中强有力地区分出来,这是未来先进基因分型检测的主要优先事项。
由CHIP突变引起的“假”阳性结果的可能性仍然是ctDNA基因分型分析的一个重大弱点。ctDNA检测在理论上具有捕获患者体内空间和时间肿瘤异质性比组织更准确的优势现在需要测序和主要的临床试验来评估检测这种异质性如何提供临床有用的信息,以改善治疗。
缺乏实用的证据阻止了将ctDNA检测纳入其他可能目的的建议,如筛查、MRD评估、MR监测和治疗反应的早期评估。目前正在开发的新技术,如基于甲基化模式的测序、基于碎片模式的测序或新型超灵敏的突变检测方法,有潜力在这些新设置中优化效用。多个临床试验正在进行中,这些试验可能为采用ctDNA分析在多种临床情况下进行决策提供证据基础。

参考文献:
1.Chawla, S.P., et al., Phase II Randomized Study of CMB305 and Atezolizumab Compared With Atezolizumab Alone in Soft-Tissue Sarcomas Expressing NY-ESO-1. J Clin Oncol, 2022. 40(12): p. 1291-1300.
2.Cufer, T., et al., Current landscape of ESMO/ASCO Global Curriculum adoption and medical oncology recognition: a global survey. ESMO Open, 2021. 6(6): p. 100219.
3.Desai, A., et al., COVID-19 vaccine guidance for patients with cancer participating in oncology clinical trials. Nat Rev Clin Oncol, 2021. 18(5): p. 313-319.
4.Gill, J. and R. Gorlick, Advancing therapy for osteosarcoma. Nat Rev Clin Oncol, 2021. 18(10): p. 609-624.
5.Gronchi, A., et al., or metastatic liposarcoma or synovial sarcoma patients: An EORTC -Soft tissue and visceral sarcomas: ESMO-EURACAN-GENTURIS Clinical Practice Guidelines for diagnosis, treatment and follow-up(). Ann Oncol, 2021. 32(11): p. 1348-1365.
6.Kantidakis, G., et al., New benchmarks to design clinical trials with advanced Soft Tissue and Bone Sarcoma Group (STBSG) meta-analysis based on a literature review for soft-tissue sarcomas. Eur J Cancer, 2022. 174: p. 261-276.
7.Leavey, P.J., et al., Phase III Trial Adding Vincristine-Topotecan-Cyclophosphamide to the Initial Treatment of Patients With Nonmetastatic Ewing Sarcoma: A Children's Oncology Group Report. J Clin Oncol, 2021. 39(36): p. 4029-4038.
8.Meltzer, P.S. and L.J. Helman, New Horizons in the Treatment of Osteosarcoma. N Engl J Med, 2021. 385(22): p. 2066-2076.
9.Pascual, J., et al., ESMO recommendations on the use of circulating tumour DNA assays for patients with cancer: a report from the ESMO Precision Medicine Working Group. Ann Oncol, 2022. 33(8): p. 750-768.
10.Pautier, P., et al., Doxorubicin alone versus doxorubicin with trabectedin followed by trabectedin alone as first-line therapy for metastatic or unresectable leiomyosarcoma (LMS-04): a randomised, multicentre, open-label phase 3 trial. The Lancet Oncology, 2022. 23(8): p. 1044-1054.
11.Saerens, M., et al., Immune checkpoint inhibitors in treatment of soft-tissue sarcoma: A systematic review and meta-analysis. Eur J Cancer, 2021. 152: p. 165-182.
12.Sanfilippo, R., et al., Activity of Cabazitaxel in Metastatic or Inoperable Locally Advanced Dedifferentiated Liposarcoma: A Phase 2 Study of the EORTC Soft Tissue and Bone Sarcoma Group (STBSG). JAMA Oncol, 2022.
13.Schoot, R.A., et al., Metastatic Rhabdomyosarcoma: Results of the European Paediatric Soft Tissue Sarcoma Study Group MTS 2008 Study and Pooled Analysis With the Concurrent BERNIE Study. J Clin Oncol, 2022: p. JCO2102981.
14.Strauss, S.J., et al., Bone sarcomas: ESMO-EURACAN-GENTURIS-ERN PaedCan Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol, 2021. 32(12): p. 1520-1536.
15.Venkataramany, A.S., et al., Alternative RNA splicing defects in pediatric cancers: new insights in tumorigenesis and potential therapeutic vulnerabilities. Ann Oncol, 2022. 33(6): p. 578-592.
16.Venkatramani, R., et al., Synovial Sarcoma in Children, Adolescents, and Young Adults: A Report From the Children's Oncology Group ARST0332 Study. J Clin Oncol, 2021. 39(35): p. 3927-3937.





 京公网安备11010502051256号
京公网安备11010502051256号