肌少症的诊疗共识解读与研究进展
2023-02-27 我要说
来源:《生物骨科材料与临床研究》2023年02月第20卷第1期
通信作者:杨强
人口老龄化已经成为了一个全球面临的公共问题,骨骼肌减少症简称肌少症(sarcopenia),是一种描述影响老年人的渐进性骨骼肌质量、力量和功能丧失的疾病,它增加了跌倒、骨折和虚弱的风险,造成相当大的社会经济负担。
随着2019年亚洲肌少症工作小组推出最新的诊断共识,人们对肌少症又有了新的认识,本文将对欧洲及亚洲肌少症工作小组最新的诊疗共识以及目前肌少症的主要研究趋势、诊疗进展以及其与退变性脊柱疾病、骨质疏松的关系等进行综述。
-------------------------------------------------
骨骼肌减少症简称肌少症(sarcopenia),源于希腊语。1989年,由Rosenberg[1]首次提出“Sarcopenia”这一术语来描述年龄相关的肌肉减少症。2010年,欧洲老年人肌少症工作组(European Working Group on Sarcopenia in Older People, EWGSOP)最早公布了肌少症的共识:肌少症是一种进行性、广泛性的骨骼肌质量及力量下降,以及由此导致的体能下降、生活质量下降和死亡等不良后果的综合征[2-3]。
肌少症是老年综合症状之一,可能增加跌倒、骨折和低生活质量的风险,进一步导致虚弱、残疾和高死亡率[4]。此外,肌少症还与多种疾病有关,如骨质疏松症、心脏病、呼吸系统疾病和认知障碍[5]。
世界60岁以上人口数量预计将在未来30年翻一番,全世界肌少症的患病人数预计将从2010年的5000万人增加到2050年的2亿人,其经济成本也在逐年激增[6-7]。肌少症已经成为危害老年人健康最重要的慢性病之一,近年来对于与年龄相关的肌少症越来越引起广泛关注,肌少症的预防和管理已被公认为一个亟待解决的全球性问题。
1 肌少症的病因
肌量和肌力在人的一生中是不断变化的,在青壮年(40岁时)达最高水平,男性高于女性。
据报道,50岁以后,人们的腿部肌量每年减少1%~2%,肌力每年减少1.5%~5%[8]。肌少症的病因通常被认为是多因素的,包括体育活动减少、营养不良、疾病诱因、炎症通路激活、神经肌肉连接丧失、线粒体异常、卫星细胞数量减少和激素变化[9]。缺乏锻炼被认为是肌少症的首要危险因素。
此外,人体激素和细胞因子失衡会导致肌肉质量和力量的损失。肌少症还与身体残疾和静止等不良后果相关,可能导致患者丧失独立性、身体更加虚弱、生活质量较差、医疗费用增加,最终导致患者死亡[10]。
2 肌少症的流行病学
由于研究人群、研究方法及诊断标准等的不同,不同研究显示肌少症的患病率存在较大差异[11-12]。目前估计其在全球范围内的患病率为10%,并且由于人口老龄化,预计在未来几十年内患病率会显著增加[13]。
据报道,中国60岁以上的社区老年人肌少症的发病率达10.4%[14]。在1000名来自日本人群的老年参与者中,使用欧洲肌少症工作组给出的诊断标准,肌少症的患病率为男性13.8%(平均年龄75.7岁),女性12.4%(平均年龄74.4岁)[15]。欧洲男性和女性(平均年龄67岁)骨骼肌减少症的患病率分别为4.6%和7.9%[16]。
3 肌少症的诊疗共识
3.1 欧洲共识解读
2010年,欧洲老年人肌少症工作组(EWGSOP)公布了肌少症的定义,在原有的基础上增加了肌肉功能,针对筛选的目标人群是65岁及以上的人。2018年(欧洲老年人肌少症工作组2次会议)EWGSOP2018更新了肌少症的定义:肌少症是一种肌肉疾病(肌肉衰竭),其根源是人在一生中发生的肌肉不良变化。
与前一版的欧洲共识相比,EWGSOP2018主要提出以下几点:①低肌力是肌少症诊断的关键特征;②进一步完善了诊断流程,分为筛查发现、明确诊断和评估严重程度;③提出了肌少症诊断的明确数据指标。此外建议使用SARC-F问卷作为筛选工具(见表1)[17]。

EWGSOP2018采用低肌力作为肌少症的主要指标:肌力低的人被诊断为“可能的肌肉减少症”;当肌肉质量较低时,个体随后被诊断为“肌减少症”;如果身体表现不佳(6m步行速度<1m/s或5次起坐时间>12s)则被诊断为“重度肌少症”[5]。
3.2 最新亚洲共识与欧洲共识的异同
亚洲人相对于欧洲人在体型、体成分组成、生活方式和体力活动方面存在差异,因此在肌少症诊断方面需有特殊考虑。2019年,亚洲肌少症工作小组(Asian Working Group for Sarcopenia, AWGS)发布肌少症共识,其定义及诊断策略类似EWGSOP2010,但基于亚洲数据对肌少症每个诊断条目的界值做了调整[18-19]。
诊断策略是此次AWGS2019的亮点,其给出适用于社区基层医疗机构、医院及研究机构的诊疗路径(见图1)。另外,AWGS2019较EWGSOP2018在诊断策略上略有不同,EWGSOP2018的肌少症定义强调肌肉力量是首要指标,在肌肉力量下降同时有肌肉质量下降可诊断为肌少症。
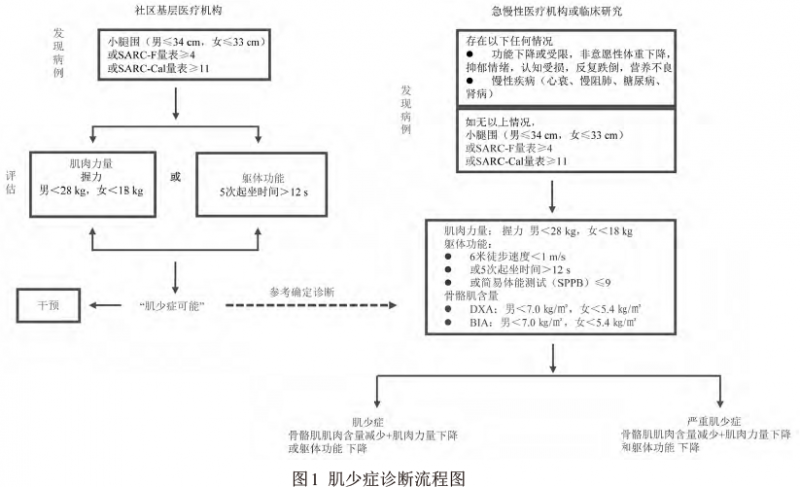
因躯体功能与不良预后相关,可作为评价肌少症的严重程度;相比EWGSOP2018,AWGS2019认为肌肉力量和躯体功能下降均是肌肉质量下降的结果,而且对预后有不良影响,因此只要肌力或功能下降,合并肌肉质量下降即可诊断为肌少症,若肌力和功能同时下降,则为严重肌少症[18]。
2014年,AWGS首次发布肌少症共识,2019年AWGS再次发布新的针对亚洲人的共识。根据AWGS2019肌少症在亚洲所采用的诊断标准如下:①肌肉力量下降(握力,男性<28kg,女性<18kg);②躯体功能下降(5次起坐时间>12s或6米徒步速度<1m/s);③骨骼肌含量(DXA:男性<7kg/m2,女性<5.4kg/m2)。诊断:①或②+③=肌少症;①+②+③=严重肌少症。
综上所述,对比AWGS2019和AWGS2014,肌少症诊断在男性握力和步速界值方面有更新,评估躯体功能已不局限于步速,5次起坐试验和简易体能测试(short physical performance battery, SPPB)可代替步速。AWGS2019更加注重诊断界值对不良临床结局的预测价值,由此强调诊断对干预的意义。
3.3 肌减少症影像学:旧证据和新见解
多种成像方式,包括双能X线骨密度仪(DXA)、计算机断层扫描(CT)、磁共振(MR)和超声(US)可用于评估肌肉质量,并辅助肌少症的诊断[20]。在不同程度上,所有这些方法都可以为肌少症的诊断提供定量数据,因此随着时间的推移是可重复和可比较的。
DXA是临床实践中最常用的一种,具有准确和广泛可用的优点,也是唯一具有公认的肌少症诊断截止值的放射学工具;CT和MR被认为是评价肌肉质量和脂肪浸润的参考标准;超声一直被认为是肌少症的一个小工具,但由于其重现性较低、准确性低并且操作者技术差异大,应用较少。到目前为止,CT可能是最简单和最有前途的方式,尽管受限于肌肉分割所需的长时间。通过总结各种影像学检查手段在肌肉减少症诊断中的应用优缺点,来指导临床工作(见表2)。

4 肌少症的相关研究进展
4.1 肌少症与退变性脊柱疾病的关系
在临床中很多腰椎管狭窄、退变性脊柱侧弯的患者,通过检查往往合并有肌少症,肌少症与退变性脊柱疾病的关系是近年来研究的热点,一些研究调查了腰椎管狭窄(lumbar spinal stenosis,LSS)患者肌减少症的患病率[21-22]。
Matsuo等[23]发现,与健康的老年人相比,LSS患者有更高的肌少症患病率,他们将178例患者被纳入研究:其中肌少症组35例和非肌少症组143例,发现肌少症的患病率为19.7%,肌少症组患者的腰椎椎体平均滑移率明显高于非肌少症组;与无肌少症的患者相比,LSS和肌少症的患者有更高程度的腰椎滑移和更低的BMI、BMD和身体功能,并报道更严重的腰痛。
Park等[21]报道了由握力(低握力)定义的肌少症男性<26kg,女性<18kg),与年龄和性别匹配的对照组(平均年龄68.2岁,肌少症患病率24%)相比,在LSS患者中更普遍(平均年龄67.9岁;肌少症患病率为24%)。
Eguchi等[22]报道,肌少症的患病率(定义为四肢骨骼肌含量<5.46kg/m2)在LSS女性患者中为16%(平均年龄72.9岁),在退行性腰椎侧凸女性患者中为46.6%(平均年龄74.8岁)。
关于躯干肌肉与椎体滑移的关系,Zhu等[24]在体外的有限元研究中证明了背部肌肉力量的减少导致腰椎下段剪切力的明显变化。该小组的结论是,从生物力学的角度来看,减少整个背部肌肉的力量可能会导致或加剧伴有前滑的退行性椎体滑移。在这里,肌少症组不仅有较低的四肢肌肉量,他们比非肌少症组也有较低的躯干肌肉量。因此,躯干肌萎缩可能加重了LSS和肌少症患者的退行性椎体滑移。
4.2 肌少症与骨质疏松的关系
近年来的基础和临床研究集中在肌少症与骨质疏松的关系上[25-26]。
Hida等[25]报道,与无髋部骨折的患者相比,髋部骨折患者有更高的肌少症患病率和更多的腿部肌肉质量和全身骨密度(BMD)下降。肌肉质量的增加与骨量的增加和骨折风险的降低有关[27],在一项对老年男性的前瞻性研究中发现,老年男性中合并有骨骼肌少症者发生骨折的风险显著增加[28]。
握力较低与总体积骨密度和皮质厚度的快速下降有关[29],肌肉组织和骨代谢之间的一些联系可能被体液因子的释放所调节。骨骼肌被认为是人体最大的内分泌器官,由骨骼肌细胞分泌的体液因子被称为“肌因子”。骨还具有内分泌器官的功能,由成骨细胞或骨细胞分泌的体液因子称为“骨因子”。
最近发现了一个新基因序列FAM210A[30],该序列在人体的肌肉线粒体和细胞质中表达,而在骨中不表达。敲除FAM210A的小鼠出现下降骨密度、骨生物力学强度和破骨细胞活性升高伴小梁骨和皮质骨的微结构恶化。这些发现表明FAM210A可能参与调节骨结构和功能。此外,肌少症显示出老年人跌倒和随后骨折的风险增加,特别是与骨质疏松症相关时[31-33]。
5 肌少症的治疗进展
迄今为止,临床实践中用于肌少症的治疗方案包括补充蛋白质、氨基酸、维生素D和肌酸[34-35],通过阻力训练来增加肌肉含量和力量[36-37],振动疗法已经被证明可以提高身体性能[38]。
近年来,干细胞疗法由于其再生能力和产生抗炎细胞因子,而抗炎细胞因子反过来改变微环境,促进神经再生和再生方面的不断研究,有可能成为缓解肌少症的一种新的治疗干预手段[39-40]。然而,干细胞移植受到几个因素的限制,包括伦理、排斥反应和生产限制,因此,使用干细胞分泌体(干细胞产生的主要抗炎成分)可能是比直接使用干细胞更好的选择。
更重要的是,到目前为止,许多关于肌少症的研究都在研究运动、营养和蛋白质补充剂对人体减轻肌少症的影响,但没有人观察运动与同时使用干细胞分泌组的影响,这可能是一种新的抗肌少症方法,可能提供比其他经典方法更好的结果。
6 小结与展望
肌少症是一种与年龄相关的衰弱状态,其特征是骨骼肌质量和力量的进行性和广泛性丧失,这是老龄化世界的一个严重问题。随着亚洲、欧洲肌少症工作组共识的不断更新及世界各地对肌少症的发病率、诊断、治疗的不断深入研究,强调肌力重要性的肌少症新诊断标准已经逐渐建立,这将进一步促进临床实践和相关基础研究。
此外,肌少症近几年的研究热点主要集中在与老年人消耗性、退变性疾病相关领域,如恶性肿瘤、肝病、神经系统疾病、骨科疾病等。随着研究的不断深入,文献的不断更新,今后可能会看到更多的与老年人肌少症相关性疾病的研究、报道。
参考文献:
[1] Rosenberg I. Epidemiologic and methodologic problems in determining nutritional status of older persons[J]. Am J Clin Nutr, 1989, 50(Suppl 5): 1121-1235.
[2] Cruz-Jentoft AJ, Baeyens JP, et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People[J]. Age Ageing, 2010, 39(4): 412-423.
[3] DiGirolamo DJ, Kiel DP, Esser KA. Bone and skeletal muscle: Neighbors with close ties[J]. J Bone Miner Res, 2013, 28(7): 1509-1518.
[4] Yakabe M, Ogawa S, Akishita M. Clinical manifestations and pathophysiology of sarcopenia[J]. RNA and Transcription, 2015, 1(2): 10-17.
[5] Cruz-Jentoft AJ, Bahat G, Bauer J, et al. Sarcopenia: Revised European consensus on definition and diagnosis[J]. Age Ageing, 2019, 48(1): 16-31.
[6] Cruz-Jentoft AJ, Baeyens JP, Bauer JM, et al. Sarcopenia: European consensus on definition and diagnosis—report of the European Working Group on Sarcopenia in Older People[J]. Age Ageing, 2010, 39(4): 412-423.
[7] Janssen I, Shepard DS, Katzmarzyk PT, et al. The healthcare costs of sarcopenia in the United States[J]. J Am Geriatr Soc, 2004, 52(1): 80-85.
[8] Masanes F, Culla A, Navarro-Gonzalez M, et al. Prevalence of sarcopenia in healthy community-dwelling elderly in an urban area of Barcelona (Spain)[J]. J Nutr Health Aging, 2012, 16(2): 184-187.
[9] Walston JD. Sarcopenia in older adults[J]. Curr Opin Rheumatol, 2012, 24: 623-627.
[10] Hairi NN, Bulgiba A, Hiong TG, et al. Sarcopenia in older people. In: AtwoodCS, editor. Geriatrics[M]. London: Intech Open, 2012: 30-40.
[11] Bouchard DR, Dionne IJ, Brochu M. Sarcopenic/obesity and physical capacity in older men and women: Data from the nutrition as a determinant of successful aging (Nu Age)-the Quebec longitudinal study[J]. Obesity(Silver Spring), 2009, 17(11): 2082-2088.
[12] Han P, Kang L, Guo Q, et al. Prevalence and factors associated with sarcopenia in suburb dwelling older Chinese using the Asian Working Group for sarcopenia definition[J]. J Gerontol A Biol Sci Med Sci, 2016, 71(4): 529-535.
[13] Cruz-Jentoft AJ, Landi F, Schneider SM, et al. Prevalence of and interventions for sarcopenia in ageing adults: a systematic review. Report of the International Sarcopenia Initiative (EWGSOP and IWGS) [J]. Age Ageing, 2014, 43(6): 748-759.
[14] Wang H, Hai S, Cao L, et al. Estimation of prevalence of sarcopenia by using a new bioelectrical impedance analysis in Chinese communitydwelling elderly people[J]. BMC Geriatr, 2016, 16(1): 216.
[15] Akune T, Muraki S, Oka H, et al. Exercise habits during middle age are associated with lower prevalence of sarcopenia: The ROAD study[J]. Osteoporos Int, 2014, 25(3): 1081-1088.
[16] Yoshimura N, Muraki S, Oka H, et al. Is osteoporosis a predictor for future sarcopenia or vice versa? Four-year observations between the second and third ROAD study surveys[J]. Osteoporos Int, 2017, 28(1): 189-199.
[17] Malmstrom TK, Miller DK, Simonsick EM, et al. SARC-F: A symptom score to predict persons with sarcopenia at risk for poor functional outcomes[J]. J Cachexia Sarcopenia Muscle, 2016, 7(1): 28-36.
[18] 姜珊, 康琳, 刘晓红. 2019亚洲肌少症诊断及治疗共识解读[J]. 中华老年医学杂志, 2020, 39(4): 373-376.
[19] Chen LK, Woo J, Assantachai P, et al. Asian Working Group for Sarcopenia: 2019 consensus update on sarcopenia diagnosis and treatment[J]. J Am Med Dir Assoc, 2020, 21(3): 300-307.
[20] Albano D, Messina C, Vitale J, et al. Imaging of sarcopenia: Old evidence and new insights[J]. Eur Radiol, 2020, 30(4): 2199-2208.
[21] Park S, Kim HJ, Ko BG, et al. The prevalence and impact of sarcopenia on degenerative lumbar spinal stenosis[J]. Bone Joint J, 2016, 98-B(8): 1093-1098.
[22] Eguchi Y, Suzuki M, Yamanaka H, et al. Associations between sarcopenia and degenerative lumbar scoliosis in older women[J]. Scoliosis Spinal Disord, 2017, 12: 9.
[23] Matsuo S, Kawakami M, Minetama M, et al. Clinical features of sarcopenia in patients with lumbar spinal stenosis[J]. Spine (Phila Pa 1976), 2020, 45(17): E1105-E1110.
[24] Zhu R, Niu WX, Zeng ZL, et al. The effects of muscle weakness on degenerative spondylolisthesis: A finite element study[J]. Clin Biomech (Bristol, Avon), 2017, 41: 34-38.
[25] Hida T, Ishiguro N, Shimokata H, et al. High prevalence of sarcopenia and reduced leg muscle mass in Japanese patients immediately after a hip fracture[J]. Geriatr Gerontol Int, 2013, 13(2): 413-420.
[26] Blain H, Vuillemin A, Teissier A, et al. Influence of muscle strength and body weight and composition on regional bone mineral density in healthy women aged 60 years and over[J]. Gerontology, 2001, 47(4): 207-212.
[27] Kawao N, Kaji H. Interactions between muscle tissues and bone metabolism[J]. J Cell Biochem, 2015, 116(5): 687-695.
[28] Wong RMY, Wong H, Zhang N, et al. The relationship between sarcopenia and fragility fracture—a systematic review[J]. Osteoporos Int, 2019, 30(3): 541-553.
[29] Wagner P, Chapurlat R, Ecochard R, et al. Low muscle strength and mass is associated with the accelerated decline of bone microarchitecture at the distal radius in older men: The prospective STRAMBO study[J]. J Bone Miner Res, 2018, 33(9): 1630-1640.
[30] Tanaka KI, Xue Y, Nguyen-Yamamoto L, et al. FAM210A is a novel determinant of bone and muscle structure and strength[J]. Proc Natl Acad Sci U S A, 2018, 115(16): E3759-E3768.
[31] Mattera M, Reginelli A, Bartollino S, et al. Imaging of metabolic bone disease[J]. Acta Biomed, 2018, 89(1-S): 197-207.
[32] Hirschfeld HP, Kinsella R, Duque G. Osteosarcopenia: Where bone, muscle, and fat collide[J]. Osteoporos Int, 2017, 28(10): 2781-2790.
[33] Messina C, Monaco CG, Ulivieri FM, et al. Dual-energy X-ray absorptiometry body composition in patients with secondary osteoporosis[J]. Eur J Radiol, 2016, 85(8): 1493-1498.
[34] Bauer JM, Verlaan S, Bautmans I, et al. Effects of a vitamin D and leucine-enriched whey protein nutritional supplement on measures of sarcopenia in older adults, the PROVIDE study: A randomized, doubleblind, placebo-controlled trial[J]. J Am Med Dir Assoc, 2015, 16(9): 740-747.
[35] Candow DG, Chilibeck PD, Forbes SC. Creatine supplementation and aging musculoskeletal health[J]. Endocrine, 2014, 45(3): 354-361.
[36] Hassan BH, Hewitt J, Keogh JW, et al. Henwood TR. Impact of resistance training on sarcopenia in nursing care facilities: A pilot study[J]. Geriatr Nurs, 2016, 37(2): 116-121.
[37] Suetta C, Magnusson SP, Rosted A, et al. Resistance training in the early postoperative phase reduces hospitalization and leads to muscle hypertrophy in elderly hip surgery patients—a controlled, randomized study[J]. J Am Geriatr Soc, 2004, 52(12): 2016-2022.
[38] Lau RW, Liao LR, Yu F, et al. The effects of whole body vibration therapy on bone mineral density and leg muscle strength in older adults: A systematic review and meta-analysis[J]. Clin Rehabil, 2011, 25(11): 975-988.
[39] Lo JH, U KP, Yiu T, et al. Sarcopenia: Current treatments and new regenerative therapeutic approaches[J]. J Orthop Translat, 2020, 23: 38-52.
[40] 邱裕佳, 王伟. 成肌细胞原代培养及临床应用前景[J]. 生物骨科材料与临床研究, 2017, 14(2): 72-75.


 京公网安备11010502051256号
京公网安备11010502051256号