3D打印一体化假体治疗髋臼周围骨肿瘤临床经验
2022-08-01 我要说
作者:闵理
医院:四川大学华西医院骨科


一、背景
功能性重建骨盆肿瘤切除后残留的巨大骨缺损是骨肿瘤外科医生必须面对的巨大挑战。自20世纪70年代开始,多种非假体重建方式应运而生,包括髋关节旷置,髂-股骨融合或假关节重建,结构性同种异体骨重建,自体股骨重建+髋关节置换以及自体瘤骨灭活回植。这些方案虽然在部分病人中取得了较好的术后功能,但他们均存在不可避免的缺陷,比如术后长时间制动,双下肢不等长,深部感染,来源有限,骨不愈合,肿瘤复发等。
近年来,半骨盆假体重建因其初始稳定性较好、外形更易被接受以及功能恢复相对较快等因素,逐渐占据骨盆恶性肿瘤治疗的主导地位[1]。迄今为止,已知的半骨盆假体类型主要有马鞍式(saddle)假体、冰激凌锥形(icecream cone)假体、组配式(modular)假体和定制式(custom-made)假体。
马鞍式假体未与宿主骨形成稳定的骨性连接,整体功能较差,并且并发症发生率较高[2-5](图1)。冰激凌假体与宿主骨的连接更加紧密,但不适合骨盆I区大部分切除的骨缺损,不能重建完整骨盆环[6-10](图2)。组配式半骨盆假体组装灵活,且可进行骨盆环完整重建,但其安装技术要求高,假体组件间存在断裂风险,不匹配得假体与宿主骨锚定将直接影响骨整合,最终易导致松动[1,11-15](图3)。

图1 马鞍式假体
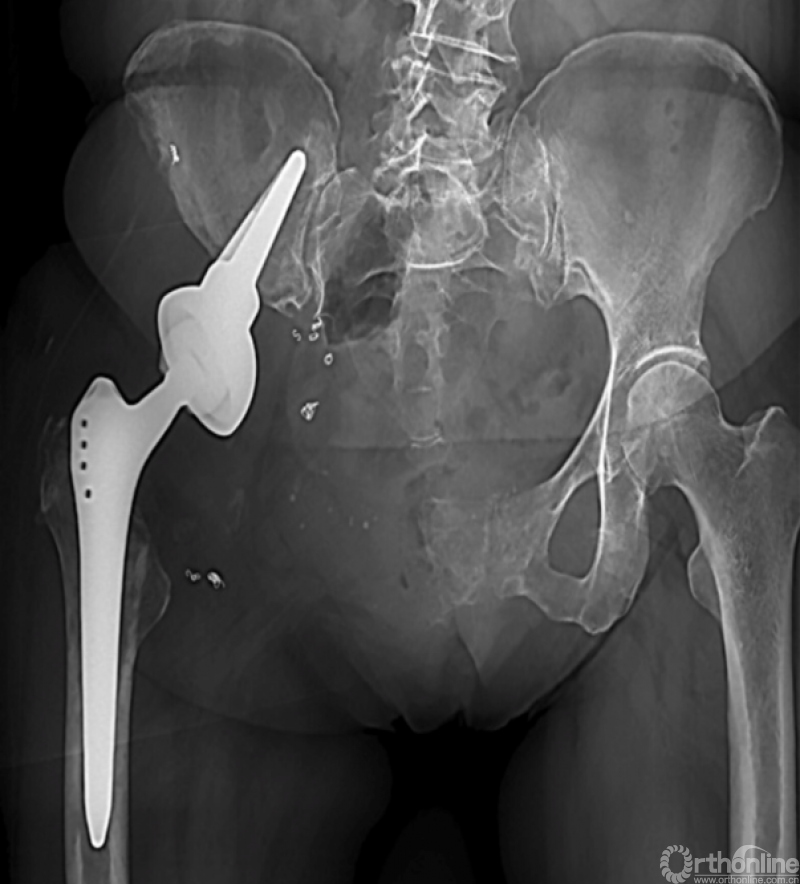
图2 冰激凌假体
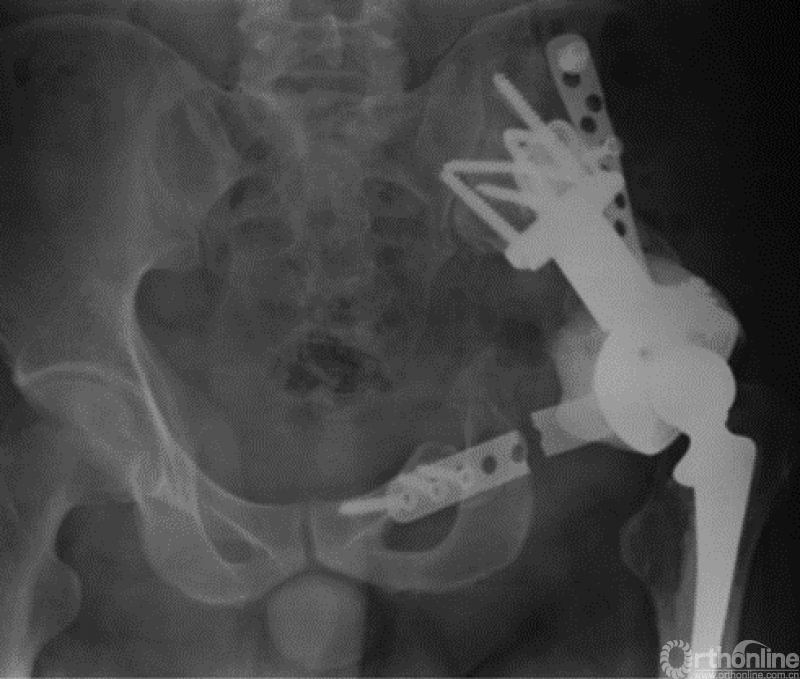
图3 组配式半骨盆假体
自1971年第一例定制化半骨盆假体投入临床应用起,其设计理念及方法一直在快速发展[16]。随着3D打印技术的应用以及假体设计进一步改良,定制化半骨盆假体的预后已经得到了长足进步[17-26](图4)。
但这种假体设计仍存在可以改善的地方,比如一体化设计以及重建完整骨盆环。一体化设计可从整体考虑假体力学分布及传导,重建完整骨盆环可获得骨盆三维稳定进而增强假体稳定性,避免后期的假体移位、松动及断裂[20, 27]。目前来看,具备这两种性质的定制假体仅由Wong等人报道过,但其应用仅为一例骨缺损较小的病例,并且骨盆连续性尚未被完全破坏[28]。
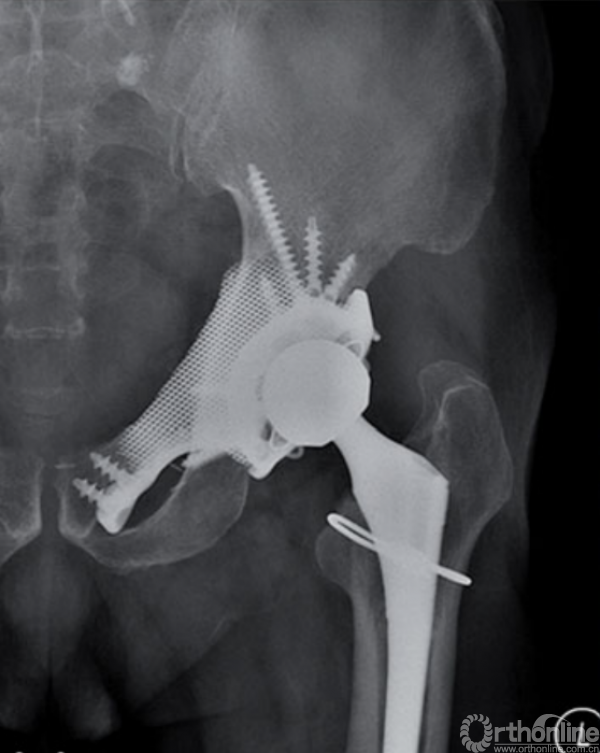
图4 3D打印定制化半骨盆假体
二、3D打印定制一体化半骨盆假体的临床应用
四川大学华西医院骨科骨与软组织肿瘤中心自主设计研发了3D打印定制一体化半骨盆假体,并应用于临床治疗。
1. 3D打印定制一体化半骨盆假体设计和制造
假体均由四川大学华西医院骨与软组织肿瘤中心临床团队设计并由企业制造。个性化模拟正常的尺寸和外观是假体设计和制造的主要原则。将CT数据导入Mimics V20.0 (Materialise Corp.,Leuven,Belgium)中建立虚拟三维模型,此后,利用图像融合技术将MRI数据整合至虚拟三维模型中用以显示肿瘤边界(图5)。
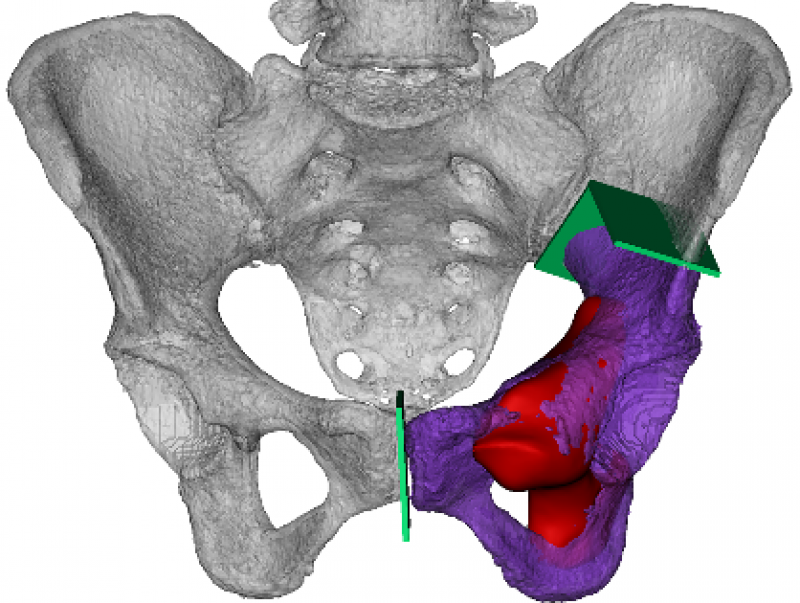
图5 图像融合技术将MRI数据整合至虚拟三维模型
假体主体由髂骨翼缩小简化而来,髂后上下棘及坐骨棘均被移除。假体由实心结构和类骨小梁多孔结构组成。实心结构包括沿弓状缘延伸的“弧形”支撑结构,螺钉孔,髋臼和耻骨支。类骨小梁多孔结构特征为600μm孔径和70%孔隙率。众多缝线孔沿假体嵴分布用以重建臀肌及髂肌。截骨导板固定在肿瘤侧。
所有假体在近端通过平整类骨小梁多孔表面连接切除后残留髂骨或骶骨,并用松质骨螺钉固定。在远端,部分假体通过类骨小梁多孔半球面与残余髋臼连接,部分假体通过类骨小梁多孔耻骨柄或者耻骨帽与残余耻骨连接。坐骨支重建由坐骨结节的保存情况决定。
假体通过电子束熔融技术生产,同时假体模型及截骨导板采用光固化技术进行生产。假体设计(2天)、制作(3天)、后处理(2天)以及运输(3天)共需10天左右。
2. 手术方法
同其他半骨盆置换手术。但应注意采用截骨导板辅助精准截骨。假体植入前,对于保留的骶髂关节面使用咬骨钳显露松质骨,对于保留的髋臼采用髋臼挫或其他方式处理骨面使骨面与假体相应部分匹配。假体在接触面处理完成后一次植入,优先固定耻骨后再复位假体行髂骨或骶骨固定。在坐骨保留的情况下,通常最后进行固定。
3. 术后处理
术后患肢处于旋转中立位,15-25°外展,15°髋关节屈曲位和15°膝关节屈曲位,并辅以梯形枕和防旋鞋维持体位。术后3天内,通过测试评估髋臼周围肌力及稳定性确定早期康复方案。
若患者具备早期康复条件,在术后1周内继续加强髋部肌肉的力量和平衡。术后2周内,进行站立不负重屈髋训练。术后2周后,患肢的负重从10kg逐渐增加直到与健肢受力相等(持续时间一般为2周)。术后4周,允许患者进行髋关节外展、内收、后伸训练,并配合助行器练习行走。
否则需采用骨盆-大腿支具固定。术后2-3周内进行日常床上训练。3周后,患者可进行站立不负重屈髋训练。术后4周后,逐渐从10公斤开始负重直到增加至全重(持续时间一般为2周)。术后6-8周进行髋部外展、内收、后伸训练,并采用助行器练习行走。
在术后前3个月,患者睡眠情况下均需T型枕及防旋鞋辅助。此后,所有患者都被鼓励在没有拐杖的情况下行走,并被告知开始为期一周的翘二郎腿和下蹲训练。在此训练完成后病人可以不需要辅助器械行走并屈髋≥90°。
三、3D打印定制一体化半骨盆假体的优势
1. 假体创新设计利于精准重建三维骨盆环,为骨整合提供必要条件
自上世纪70年代以来,定制化假体以其形态重建的精准化逐步成为主流。但以往的定制化假体以减材制造为主,涂层覆盖甚至于抛光的假体表面导致假体骨界面骨整合不良,进而不可避免地出现假体机械性失效[17,19,21]。
得益于增材制造(3D打印)技术的纵深发展和对于骨整合理论的深入理解,近期,3D打印类骨小梁多孔结构定制化假体已被成功运用于临床[20,27-32]。然而,即便在假体骨界面获得较为满意的骨整合,组配式假体多关节连接方式依旧存在松动甚至断裂可能性。另外,骨盆肿瘤在切除后,整个骨盆环将呈现纵向与横向的移位,部分假体会以牺牲III区连接来使假体植入更为便捷,但完整的骨盆环重建不仅可以增加半骨盆假体的三维稳定和改善假体重建后骨盆的力学传导,更是避免患者术后并发症的必要措施。
假体置换的长期目标是为患者重返社会提供持久的静力支持。因此,假体强度和界面骨整合能力成为关注焦点。为了增强假体整体强度,假体内部由实心结构构成,将弓状缘支撑结构、髋臼、螺钉孔、耻骨等在内的连续于一体。骨整合能力与界面结构、初始稳定性和应力刺激有关。
本研究中的假体界面均采用已被证实具有促进骨形成的能力的多孔结构[33-39]。在术中,尽可能显露宿主骨小梁结构连接假体界面,辅以股骨头自体骨移植以促进骨整合。
此外,假体耻骨部分采用耻骨柄或耻骨帽等设计增大假体与残余耻骨的接触面。充分的初始稳定性可以通过设计良好的螺钉方向和三维解剖重建骨盆环来实现[20]。
第三,在术后康复中早期加入适当负重锻炼,通过适当应力刺激进一步促进假体界面骨整合,增强假体稳定性。
2. 重视术前精准方案设计与围术期个性化康复利于患者功能重建
骨盆肿瘤通常处于较深位置,要获取良好视野需要分离众多肌肉及软组织,术前对手术入路的精确分析确定最佳手术入路可以尽可能的减少额外的肌肉损伤,从而保证保留更多的功能。
其次,术中手术导板应用减小不必要切口暴露、减少周围正常肌肉损害的情况下达到enbloc切除。
第三,完整骨盆环及原位髋臼重建保证了骨盆三维稳定及正常应力传导,为术后早期功能锻炼提供坚实基础。同时,早期负重促进骨整合,更有利于重建骨盆稳定,最终提升术后功能恢复水平[40]。
第四,术中尽可能保留肌肉附着点骨组织,在重建缝合肌肉止点时,以骨-金属重建替代肌腱-金属重建,加强稳定性。利于早期锻炼。
第五,个性化术后康复计划最大化利用留存肌肉能力,从而达到较好的功能恢复。
3. 注重术前手术模拟与实际手术操作利于并发症防治
基于CT并融合MRI数据的多模态图像融合技术,生成虚拟三维图像,精准显示肿瘤范围,并通过精确的肿瘤边界分析,仔细的手术模拟,精准的手术导板设计以及严格按照计划的手术操作,最终达到良好的局部肿瘤控制,精准安放假体减少脱位。
另外,该假体具有仿生流线型形态和粗糙表面多孔结构,为软组织长入提供必要条件,可有效减少术后死腔。
第三,截骨导板和塑料模型的应用,显著减少了手术和假体暴露时间。
参考文献(滑动展示):
1. Guo W, Li D, Tang X, Yang Y, Ji T: Reconstruction with modular hemipelvic prostheses for periacetabular tumor. Clin Orthop Relat Res 2007, 461:180-188.
2. Aljassir F, Beadel GP, Turcotte RE, Griffin AM, Bell RS, Wunder JS, Isler MH: Outcome after pelvic sarcoma resection reconstructed with saddle prosthesis. Clin Orthop Relat Res 2005, 438:36-41.
3. Donati D, D'Apote G, Boschi M, Cevolani L, Benedetti MG: Clinical and functional outcomes of the saddle prosthesis. J Orthop Traumatol 2012, 13(2):79-88.
4. Jansen JA, van de Sande MA, Dijkstra PD: Poor long-term clinical results of saddle prosthesis after resection of periacetabular tumors. Clin Orthop Relat Res 2013, 471(1):324-331.
5. Falkinstein Y, Ahlmann ER, Menendez LR: Reconstruction of type II pelvic resection with a new peri-acetabular reconstruction endoprosthesis. J Bone Joint Surg Br 2008, 90(3):371-376.
6. Bus MP, Szafranski A, Sellevold S, Goryn T, Jutte PC, Bramer JA, Fiocco M, Streitburger A, Kotrych D, van de Sande MA et al: LUMiC((R)) Endoprosthetic Reconstruction After Periacetabular Tumor Resection: Short-term Results. Clin Orthop Relat Res 2017, 475(3):686-695.
7. Issa S-P, Biau D, Babinet A, Dumaine V, Le Hanneur M, Anract P: Pelvic reconstructions following peri-acetabular bone tumour resections using a cementless ice-cream cone prosthesis with dual mobility cup. International Orthopaedics 2018, 42(8):1987-1997.
8. Barrientos-Ruiz I, Ortiz-Cruz EJ, Peleteiro-Pensado M: Reconstruction After Hemipelvectomy With the Ice-Cream Cone Prosthesis: What Are the Short-term Clinical Results? Clin Orthop Relat Res 2017, 475(3):735-741.
9. Fisher NE, Patton JT, Grimer RJ, Porter D, Jeys L, Tillman RM, Abudu A, Carter SR: Ice-cream cone reconstruction of the pelvis: a new type of pelvic replacement: early results. J Bone Joint Surg Br 2011, 93(5):684-688.
10. Hipfl C, Stihsen C, Puchner SE, Kaider A, Dominkus M, Funovics PT, Windhager R: Pelvic reconstruction following resection of malignant bone tumours using a stemmed acetabular pedestal cup. Bone Joint J 2017, 99-B(6):841-848.
11. Ogura K, Susa M, Morioka H, Matsumine A, Ishii T, Hamada K, Ueda T, Kawai A: Reconstruction using a constrained-type hip tumor prosthesis after resection of malignant periacetabular tumors: A study by the Japanese Musculoskeletal Oncology Group (JMOG). J Surg Oncol 2018, 117(7):1455-1463.
12. Wang B, Xie X, Yin J, Zou C, Wang J, Huang G, Wang Y, Shen J: Reconstruction with modular hemipelvic endoprosthesis after pelvic tumor resection: a report of 50 consecutive cases. PLoS One 2015, 10(5):e0127263.
13. Zhou Y, Duan H, Liu Y, Min L, Kong Q, Tu C: Outcome after pelvic sarcoma resection and reconstruction with a modular hemipelvic prostheses. Int Orthop 2011, 35(12):1839-1846.
14. Guo Z, Li J, Pei GX, Li XD, Wang Z: Pelvic reconstruction with a combined hemipelvic prostheses after resection of primary malignant tumor. Surg Oncol 2010, 19(2):95-105.
15. Ji T, Guo W, Yang RL, Tang XD, Wang YF: Modular hemipelvic endoprosthesis reconstruction--experience in 100 patients with mid-term follow-up results. Eur J Surg Oncol 2013, 39(1):53-60.
16. Enneking WF, Dunham WK: Resection and reconstruction for primary neoplasms involving the innominate bone. J Bone Joint Surg Am 1978, 60(6):731-746.
17. Ozaki T, Hoffmann C, Hillmann A, Gosheger G, Lindner N, Winkelmann W: Implantation of hemipelvic prosthesis after resection of sarcoma. Clin Orthop Relat Res 2002(396):197-205.
18. Jaiswal PK, Aston WJ, Grimer RJ, Abudu A, Carter S, Blunn G, Briggs TW, Cannon S: Peri-acetabular resection and endoprosthetic reconstruction for tumours of the acetabulum. J Bone Joint Surg Br 2008, 90(9):1222-1227.
19. Abudu A, Grimer RJ, Cannon SR, Carter SR, Sneath RS: Reconstruction of the hemipelvis after the excision of malignant tumours. Complications and functional outcome of prostheses. J Bone Joint Surg Br 1997, 79(5):773-779.
20. Wang B, Hao Y, Pu F, Jiang W, Shao Z: Computer-aided designed, three dimensional-printed hemipelvic prosthesis for peri-acetabular malignant bone tumour. Int Orthop 2018, 42(3):687-694.
21. Holzapfel BM, Pilge H, Prodinger PM, Toepfer A, Mayer-Wagner S, Hutmacher DW, von Eisenhart-Rothe R, Rudert M, Gradinger R, Rechl H: Customised osteotomy guides and endoprosthetic reconstruction for periacetabular tumours. Int Orthop 2014, 38(7):1435-1442.
22. Dai KR, Yan MN, Zhu ZA, Sun YH: Computer-aided custom-made hemipelvic prosthesis used in extensive pelvic lesions. J Arthroplasty 2007, 22(7):981-986.
23. Sun W, Li J, Li Q, Li G, Cai Z: Clinical effectiveness of hemipelvic reconstruction using computer-aided custom-made prostheses after resection of malignant pelvic tumors. J Arthroplasty 2011, 26(8):1508-1513.
24. Witte D, Bernd L, Bruns J, Gosheger G, Hardes J, Hartwig E, Lehner B, Melcher I, Mutschler W, Schulte M et al: Limb-salvage reconstruction with MUTARS hemipelvic endoprosthesis: a prospective multicenter study. Eur J Surg Oncol 2009, 35(12):1318-1325.
25. Müller HDBP: Internal hemipelvectomy and reconstruction with a megaprosthesis. International Orthopaedics 2002, 26(2):76-79.
26. Angelini A, Trovarelli G, Berizzi A, Pala E, Breda A, Ruggieri P: Three-dimension-printed custom-made prosthetic reconstructions: from revision surgery to oncologic reconstructions. International Orthopaedics 2018.
27. Li S, Li X, Hou W, Nune KC, Misra RDK, Correa-Rodriguez VL, Guo Z, Hao Y, Yang R, Murr LE: Fabrication of open-cellular (porous) titanium alloy implants: osseointegration, vascularization and preliminary human trials. Science China Materials 2017, 61(4):525-536.
28. Wong KC, Kumta SM, Geel NV, Demol J: One-step reconstruction with a 3D-printed, biomechanically evaluated custom implant after complex pelvic tumor resection. Comput Aided Surg 2015, 20(1):14-23.
29. Wong KC, Kumta SM, Chiu KH, Cheung KW, Leung KS, Unwin P, Wong MC: Computer assisted pelvic tumor resection and reconstruction with a custom-made prosthesis using an innovative adaptation and its validation. Comput Aided Surg 2007, 12(4):225-232.
30. Liang H, Ji T, Zhang Y, Wang Y, Guo W: Reconstruction with 3D-printed pelvic endoprostheses after resection of a pelvic tumour. Bone Joint J 2017, 99-B(2):267-275.
31. Chen X, Xu L, Wang Y, Hao Y, Wang L: Image-guided installation of 3D-printed patient-specific implant and its application in pelvic tumor resection and reconstruction surgery. Comput Methods Programs Biomed 2016, 125:66-78.
32. Liu X, Liu Y, Lu W, Liao S, Du Q, Deng Z, Lu W: Combined Application of Modified Three-Dimensional Printed Anatomic Templates and Customized Cutting Blocks in Pelvic Reconstruction After Pelvic Tumor Resection. J Arthroplasty 2019, 34(2):338-345 e331.
33. Palmquist A, Snis A, Emanuelsson L, Browne M, Thomsen P: Long-term biocompatibility and osseointegration of electron beam melted, free-form-fabricated solid and porous titanium alloy: experimental studies in sheep. J Biomater Appl 2013, 27(8):1003-1016.
34. Shah FA, Omar O, Suska F, Snis A, Matic A, Emanuelsson L, Norlindh B, Lausmaa J, Thomsen P, Palmquist A: Long-term osseointegration of 3D printed CoCr constructs with an interconnected open-pore architecture prepared by electron beam melting. Acta Biomater 2016, 36:296-309.
35. Taniguchi N, Fujibayashi S, Takemoto M, Sasaki K, Otsuki B, Nakamura T, Matsushita T, Kokubo T, Matsuda S: Effect of pore size on bone ingrowth into porous titanium implants fabricated by additive manufacturing: An in vivo experiment. Materials Science and Engineering: C 2016, 59:690-701.
36. Wang C, Liu D, Xie Q, Liu J, Deng S, Gong K, Huang C, Yin L, Xie M, Guo Z et al: A 3D Printed Porous Titanium Alloy Rod with Diamond Crystal Lattice for Treatment of the Early-Stage Femoral Head Osteonecrosis in Sheep. Int J Med Sci 2019, 16(3):486-493.
37. Karageorgiou V, Kaplan D: Porosity of 3D biomaterial scaffolds and osteogenesis. Biomaterials 2005, 26(27):5474-5491.
38. Hara D, Nakashima Y, Sato T, Hirata M, Kanazawa M, Kohno Y, Yoshimoto K, Yoshihara Y, Nakamura A, Nakao Y et al: Bone bonding strength of diamond-structured porous titanium-alloy implants manufactured using the electron beam-melting technique. Mater Sci Eng C Mater Biol Appl 2016, 59:1047-1052.
39. Bose S, Vahabzadeh S, Bandyopadhyay A: Bone tissue engineering using 3D printing. Materials Today 2013, 16(12):496-504.
40. Ji T, Guo W, Tang XD, Dong S: [Finite element analysis for modular hemipelvic endoprosthesis during loaded gait cycle]. Beijing Da Xue Xue Bao Yi Xue Ban 2010, 42(2):192-196.
文献解读人

闵理
四川大学华西医院骨科书记兼副主任。医学博士,主任医师,教授,博士研究生导师,美国哈佛医学院麻省总医院博后。
担任中华医学会骨科学分会骨肿瘤学组肢体肿瘤工作委员会副组长,中国抗癌协会肉瘤专业委员会创新与转化学组副组长,中国抗癌协会肉瘤专业委员会骨盆学组副组长,吴阶平医学基金会骨科青年医师联盟常委,第二届SICOT中国部骨肿瘤学组常委,四川省国际医学交流促进会骨科科技创新与转化专业委员会常委,中国医师协会骨科医师分会3D打印骨科学组委员,中国抗癌协会肉瘤专业委员会委员,中华医学会创伤学分会青年委员会委员,中华医学会工程学分会数字骨科学组委员,中国抗癌协会骨肿瘤和骨转移瘤专委会委员,中国临床肿瘤协会(CSCO)肉瘤专家委员会委员,中国骨科菁英会骨肿瘤组创始会员,中国医师培训学院骨肿瘤专业委员,中国医药教育协会骨与软组织肿瘤专业委员会委员。





 京公网安备11010502051256号
京公网安备11010502051256号