综述|SIRT3在椎间盘退变中的作用及其研究进展
2022-05-11 文章来源:中国脊柱脊髓杂志 我要说
来源:中国脊柱脊髓杂志2022年第32卷第1期
作者:林甲亮,李危石
医院:北京大学第三医院骨科
椎间盘退变(intervertebral disc degeneration,IDD)是退行性脊柱疾病的重要病理基础,可导致椎间盘突出、椎管狭窄、脊柱侧凸等众多脊柱外科常见病。随着我国社会老龄化进程的加快,椎间盘退变性疾病的发病率呈上升趋势,给社会与个人带来巨大的医疗负担。目前,尚无从根本上逆转IDD进程的有效措施,故针对IDD发病机制的分子水平研究有望为IDD的治疗与预防提供新的策略,成为目前该领域研究的热点。Sirtuin家族在哺乳动物中包含7个蛋白成员(SIRT1-7),它们是酵母沉默信息调节因子2(silent information regulator 2,Sir2)的同源物,也是在物种间高度保守的烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)依赖的去乙酰化酶。SIRT3是sirtuin家族中的一员。近年来研究发现,SIRT3的异常表达除了与心血管疾病、肿瘤等有关之外,也与IDD密切相关。因此,笔者系统地对SIRT3的结构与功能及其在IDD中的作用综述如下。
1.SIRT3蛋白的结构与功能
SIRT3基因位于人类第11号染色体上,其编码的蛋白质存在全长型和成熟型两种形式。SIRT3的全长形式主要存在细胞核内。当细胞处于应激状态时,全长型SIRT3可以转移至线粒体内,被基质加工肽酶裂解成28kDa的成熟型SIRT3,进而具有去乙酰化酶活性。SIRT3与其他sirtuin家族蛋白的结构相似,由一个进化保守的催化区和具有酶活性调节功能的N端和C端结构组成,其中催化区对其发挥NAD依赖的去乙酰化酶活性有重要作用。SIRT3主要在线粒体中发挥作用,调节众多代谢过程。研究发现,SIRT3可通过去乙酰化调节长链脂酰辅酶A脱氢酶(long chain acyl-CoAdehydrogenase,LCAD),在脂肪代谢中发挥重要作用,SIRT3基因敲除小鼠出现显著的脂肪堆积。同时,三羧酸循环中的异柠檬酸脱氢酶2(isocitrate dehydrogenase 2,IDH2)亦是SIRT3的靶蛋白,故SIRT3的功能状态将直接影响细胞腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)的产量。SIRT3的活性亦受NAD+/还原型烟酰胺腺嘌呤二核苷酸 (reduced nicotinamide adenine dinucleotide,NADH)比值的调控,当细胞能量需求增加时,NAD+/NADH比值增加,SIRT3活性增加。此外,SIRT3还参与维持细胞内氧化还原稳态。SIRT3是目前研究最多的线粒体sirtuin家族蛋白,其在代谢旺盛的组织中表达较高,如大脑、心脏、肾脏和肝脏。线粒体中大约1/5的蛋白质可被乙酰化,而SIRT3通过其去乙酰化作用,参与了能量代谢、氧化应激、自噬等众多细胞生理病理过程。
2.SIRT3在IDD中的作用
椎间盘是位于脊柱相邻椎体间的纤维软骨连结,由中央的髓核、外周的纤维环以及上下的软骨终板组成,具有维持脊柱稳定、减缓冲击、吸收震荡以及均分外力等生物学功能,在脊柱的保护、运动中发挥重要的作用。研究表明,IDD与年龄、遗传、负重等因素相关,其中年龄是一个非常重要的影响因素。随着年龄的增长,椎间盘将出现退行性改变,表现为中央髓核基质降解增加,蛋白多糖含量减少、水化程度降低,髓核皱缩;外周纤维环增厚,排列紊乱甚至出现裂缝;软骨终板变薄、钙化。这些病理生理的改变都与机体细胞、组织和器官层面的衰老密切相关。Sirtuin是一类被广泛研究的抗衰老蛋白,其中SIRT3被报道能够通过抗衰老相关机制延长生物体寿命,是长寿基因家族中的一员。值得注意的是,SIRT3是截至目前唯一有证据表明可影响人类寿命的sirtuin蛋白。Bellizzi等在SIRT3基因第5内含子中发现了一个可变串联重复数(variable number of tandem repeat,VNTR)多态性,该基因型的频率分布在长寿人群与对照人群中存在显著差异;进一步研究发现,VNTR区域具有等位基因特异性增强子活性,而等位基因增强子活性低的人不太可能活到老年,因而完全缺乏增强子活性的等位基因在90岁以上的意大利男性中几乎不存在。后续研究证实GATA序列结合蛋白2(GATA-binding protein 2,GATA2)和c-Jun/c-Fos可分别通过结合GATA和激活蛋白-1(activator protein-1,AP-1)位点发挥调节VNTR增强子活性的作用。来自美国梅奥医学中心的一项临床研究表明,SIRT3蛋白表达在长期久坐的成年人中随着年龄增长而降低,身体机能下降;运动则可通过提高SIRT3表达以恢复年老个体身体机能,达到类似于延长寿命的作用。以上研究提示,SIRT3有望成为延缓由年龄相关因素导致的人类IDD的关键靶点。
2.1 SIRT3在线粒体中的作用
SIRT3是线粒体sirtuin(SIRT3、SIRT4和SIRT5)中最具代表性的,具有很强的脱乙酰酶活性。它几乎涉及线粒体生物学的各个方面,如葡萄糖代谢、脂肪酸氧化、抗氧化防御和线粒体动力学。正常功能的线粒体在维持细胞的生理过程中发挥重要作用,线粒体中SIRT3的异常可导致线粒体功能障碍,从而引发多种疾病,包括肿瘤、心血管疾病、神经退行性疾病和骨与关节疾病。线粒体是细胞内生成活性氧(reactive oxygen species,ROS)的主要场所,若ROS产生过多将造成细胞氧化性损伤,甚至细胞死亡。ROS清除剂超氧化物歧化酶2(superoxide dismutase2,SOD2)是细胞内维持氧化还原稳态的关键酶,也受SIRT3的去乙酰化调节。同时,SIRT3还可以通过与叉头框蛋白O(forkhead box O,FOXO)结合,参与SOD2的转录调控,线粒体应激条件下,SIRT3的表达上调可以促进FOXO3a去乙酰化,这使得FOXO3a依赖的基因(SOD2和过氧化氢酶)表达增加,从而减少应激下细胞内过量ROS的堆积。前述研究表明,SIRT3通过直接或间接的途径调节线粒体抗氧化功能在维持细胞内氧化还原稳态中发挥至关重要的作用。
2.1.1 SIRT3调控氧化应激在IDD中的作用
研究表明,氧化应激是导致 IDD 的重要机制之一。近来,越来越多的证据表明退变的椎间盘中氧化产物增多,伴随着高氧化应激水平,提示氧化应激在IDD进程中的关键角色。各种细胞内、外刺激诱导的氧化还原稳态破坏可导致细胞内过量ROS堆积,由此引起的氧化应激反应可影响诸多细胞器,线粒体首当其冲。超细胞承受负荷的氧化应激水平将损伤线粒体,导致线粒体功能异常,如出现呼吸链电子传递受阻、氧化磷酸化异常、线粒体膜电位下降和ATP合成减少等。一方面,呼吸链电子传递的异常会导致ROS进一步堆积,从而形成放大效应的恶性循环。过量的ROS会损伤细胞内DNA等重要物质,导致细胞提前出现衰老。另一方面,受损线粒体的堆积可触发线粒体途径凋亡信号,最终导致髓核细胞死亡。据报道,细胞衰老和细胞凋亡导致的髓核细胞数量减少可能是IDD的始动因素。尽管靶向氧化应激和线粒体功能障碍的各种干预措施显示出减轻髓核细胞凋亡和延缓IDD进展的有益影响,但这些作用的详细分子机制仍有待进一步阐明。
SIRT3异常和继发的线粒体氧化还原稳态失衡是氧化应激诱导的髓核细胞衰老和凋亡的重要机制。研究表明,SIRT3的表达随着人类IDD的进展而降低,并且在体外沉默SIRT3的表达后发现大鼠髓核细胞抗氧化应激的能力降低,细胞衰老和凋亡增加;而激活SIRT3可显著抑制氧化应激诱导的髓核细胞衰老和凋亡,延缓IDD。Lin等的研究也发现,SIRT3在体外对氧化应激诱导的髓核细胞衰老有相似的作用结果。在前述的研究中,研究者都是通过过氧化氢诱导髓核细胞氧化应激,经过氧化氢处理后,髓核细胞SIRT3表达上调,同时SIRT3表现出细胞保护作用,提示此时SIRT3可能是保护性上调,通过其去乙酰化作用增加线粒体抗氧化酶系统活力,进而促进清除细胞内堆积的ROS,恢复细胞稳态和正常的生理功能。4岁左右时人髓核内的脊索细胞基本被软骨样细胞取代,因此髓核细胞在生物学功能方面与软骨细胞非常相似,它们都通过分泌细胞外基质来维持关节内基质的稳态。髓核或关节软骨细胞外基质的降解都与退变密切相关。在原代软骨细胞中,二氢杨梅素通过激活 SIRT3 可抑制软骨基质的分解代谢,维持基质稳态。同时,Lin等也发现过表达SIRT3可以保护髓核细胞外基质成分免受降解。
2.1.2 SIRT3调控线粒体功能在IDD中的作用
研究表明,晚期糖基化终末产物(advanced glycation end products,AGEs)在髓核组织中的积累可以诱导氧化微环境改变,进而导致髓核细胞线粒体功能障碍。Song等在体外用AGEs处理人髓核细胞发现,AGEs可抑制髓核细胞活力与增殖能力,同时诱导髓核细胞凋亡,模拟了体内IDD的病理过程。进一步研究发现,是线粒体途径凋亡介导了该过程,潜在的可能机制是:AGEs抑制髓核细胞SIRT3的表达,导致细胞内氧化还原稳态被打破,进而诱发细胞氧化损伤导致线粒体膜电位降低、通透性增加,这使得大量线粒体内细胞色素C向细胞质溢出,触发内在途径凋亡信号,最终导致髓核细胞凋亡。而烟酰胺单核苷酸(nicotinamide mononucleotide,NMN)给药可以减轻AGEs对SIRT3的抑制作用,进而挽救氧化应激诱导的髓核细胞凋亡。NMN是NAD+的前体,先前已有研究报道它可以恢复SIRT3的功能,如在β细胞中,给予NMN可以减轻促炎因子对SIRT3表达的抑制;此外,NMN的给药还可以恢复昼夜节律突变小鼠中SIRT3的去乙酰化酶活性。更重要的是,临床上已经开展NMN治疗某些疾病的临床试验。以上研究表明SIRT3在IDD病理机制中起重要作用,并通过改善线粒体功能来延缓IDD的进展。
越来越多的证据表明,SIRT3在调节线粒体抗氧化网络方面的作用与5′腺苷一磷酸依赖的蛋白激酶(5′adenosine monophosphate-activated protein kinase,AMPK)/过氧化物酶体增殖物激活受体γ共激活因子-1α(peroxisome proliferator-activated receptor gamma coactivator -1α,PGC-1α)通路密切相关。以上所述的SIRT3相关的髓核细胞保护作用都是由AMPK/PGC-1α信号通路所介导的。AMPK/PGC-1α通路是与能量代谢密切相关的代谢调控信号通路,在调节线粒体生物合成过程中扮演重要角色。AMPK的激活可促进PGC-1α与雌激素相关受体α之间的相互作用,该受体是SIRT3表达的关键转录因子。上述研究发现,促进AMPK/PGC-1α通路激活可加强SIRT3的细胞保护作用,而使用Compound C(AMPK通路抑制剂)抑制AMPK/PGC-1α通路则削弱了SIRT3的保护效应。这些结果表明AMPK/PGC-1α信号通路参与了SIRT3对髓核细胞的保护机制并在其中发挥重要作用。AMPK/PGC-1α通路也参与了NMN对髓核细胞的保护作用。但是,NMN是否通过靶向SIRT3在髓核细胞抗氧化应激过程中起作用尚不能确定。在软骨细胞中,Chen等发现,AMPK的激活可通过促进SIRT3表达显著抑制氧化应激和改善骨关节炎软骨细胞中线粒体DNA的完整性和功能;而AMPK缺陷的软骨细胞内,SIRT3表达显著减少。但是,该研究中AMPK是否通过PGC-1α作用于SIRT3尚不明确。有观点认为,AMPK与SIRT3间是互相调控的,至少它们之间正反馈环路,该正反馈环路通过调节软骨细胞的线粒体质量控制在骨关节炎的发生发展中扮演重要角色。此外,AMPK通路的激活还可以促进PGC-1α与其他转录因子或辅助激活因子相互作用,通过不同机制增加抗氧化相关靶基因的转录[68]。有研究发现,SIRT3可以通过激活转录因子FOXO3a增加SOD2的表达,进而在IDD中发挥抗氧化作用,延缓退变进程。但该过程是否由AMPK/PGC-1α通路所介导尚不清楚。
2.1.3 SIRT3调控线粒体自噬在IDD中的作用
线粒体自噬是控制线粒体数量与质量的关键机制。作为靶向受损线粒体的选择性自噬,线粒体自噬有助于清除细胞内因氧化损伤、老化而被淘汰的线粒体,回收再利用可用物质,从而保证细胞内物质利用最大化与最优化。研究表明SIRT3的抗氧化效应与线粒体自噬存在一定的联系。最新的研究发现,在髓核细胞中,SIRT3通过激活下游的线粒体自噬参与核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)介导的抗氧化效应,从而减轻髓核细胞氧化损伤和细胞凋亡。但是,SIRT3激活线粒体自噬的确切机制尚不清楚。Wang等亦发现,激活SIRT3可促进髓核细胞线粒体自噬进而减轻氧化应激诱导的细胞衰老与凋亡,该研究证实在和厚朴酚处理的情况下,SIRT3是通过BCL2/腺病毒E1B 19kDa相互作用蛋白3(BCL2/adenovirus E1B 19kDa interacting protein 3,Bnip3)依赖的途径激活线粒体自噬的。 而Wang等发现二甲双胍可以通过SIRT3激活PTEN诱导的激酶1(PTEN-induced kinase1,PINK1)/Parkin介导的线粒体自噬在原代软骨细胞中发挥保护作用。自噬的调控网络比较复杂,在椎间盘细胞中,SIRT3与巨自噬以及PINK1-Parkin依赖的经典线粒体自噬途径等是否有联系仍有待进一步研究。
2.2 SIRT3与SIRT1在IDD中作用的异同
据报道,其他sirtuin家族成员也在IDD病理机制中发挥一定的作用,其中以SIRT1的研究最为广泛。鉴于SIRT1与SIRT3的亚细胞定位不同,故它们的作用机制不尽相同。SIRT1主要通过抑制核因子κB(nuclear factorkappa B,NF-κB)的转录活性以及衰老相关的信号通路(p53-p21-pRb和p16-pRb信号通路)来抑制IDD过程中的炎症反应和细胞衰老;而SIRT3主要通过调节线粒体氧化应激水平来维持髓核细胞稳态。但同为sirtuin家族成员,SIRT1与SIRT3在IDD中的作用也具有相同点。例如,SIRT1与SIRT3都可以通过去乙酰化作用增加FOXO3a依赖的抗氧化酶的表达,从而减少ROS的产生。IDD是常见的脊柱退行性变,与氧化应激、细胞衰老等密切相关,而sirtuins家族作为一个庞大的长寿蛋白家族,或多或少在退变中发挥一定的作用,其更深层次的机制值得我们进一步探索。
3.总结与展望
IDD是引起腰痛的常见病因,给社会与个人带来巨大的医疗与经济负担。虽然IDD目前尚无有效的治疗药物,但近些年来随着其病理机制逐步被揭示,一些分子正展现出潜在的应用前景,SIRT3就是其中之一。靶向SIRT3的天然化合物如和厚朴酚已在动物层面证实了其对IDD的治疗作用。然而,目前的研究尚局限于椎间盘的髓核,而未研究SIRT3在IDD过程中如何在纤维环和软骨终板中作用。故要更好地将SIRT3用于IDD的诊断与治疗,还需要进一步深入的基础与临床研究。此外,最新的研究表明,SIRT3在衰老的人间充质干细胞中表达降低,且SIRT3的敲除导致人间充质干细胞出现加速衰老的表型,并伴随线粒体功能异常;而通过回补SIRT3或在老年人间充质干细胞中过表达SIRT3,均可在一定程度上改善线粒体功能异常、延缓细胞衰老。干细胞疗法已在椎间盘的临床治疗中得到初步应用。鉴于髓核中亦存在髓核干细胞,可对退变髓核组织进行修复,故若髓核干细胞的衰老也与SIRT3密切相关,这无疑为我们打开了一扇新的大门。
关于体内研究,目前采用的IDD动物模型大都为大鼠尾椎针刺模型。该模型具有造模简单、模型稳定、可重复性好等优点,但不可否认该模型存在一些局限性。首先,大鼠尾椎与人类椎间盘的受力模式不同,该模型不能完全模拟人类IDD的病理过程。其次,目前关于sirtuin蛋白在IDD中的研究尚不涉及转基因动物,现有研究多通过药物干预进行体内实验,特异性欠佳。例如,使用NMN作为调节SIRT3功能的药物进行体内干预,尽管研究结果显示SIRT3对髓核细胞凋亡和IDD具有保护作用,但NMN靶向的分子很多,这些分子与SIRT3的潜在相互作用可能会影响最终结果。因而,引入转基因动物模型可提供更有力的证据证明sirtuin蛋白在IDD中扮演的角色。另外,使用猴子、山羊或狗等大动物进行更深入的研究可能会更有说服力。
总之,SIRT3可以通过抑制氧化应激、促进线粒体自噬和维持线粒体功能来改善IDD的病理过程(图1)。考虑到SIRT3在IDD中的重要作用,它可能被发掘为有前途的IDD诊断标志物。当然,这还需要大规模、多中心的前瞻性临床试验来验证其诊断价值。最重要的是,SIRT3参与了髓核细胞衰老和凋亡的关键环节,随着与SIRT3相互作用分子的不断发现和深层分子机制的揭示,SIRT3有望成为预防和治疗IDD的重要靶点。
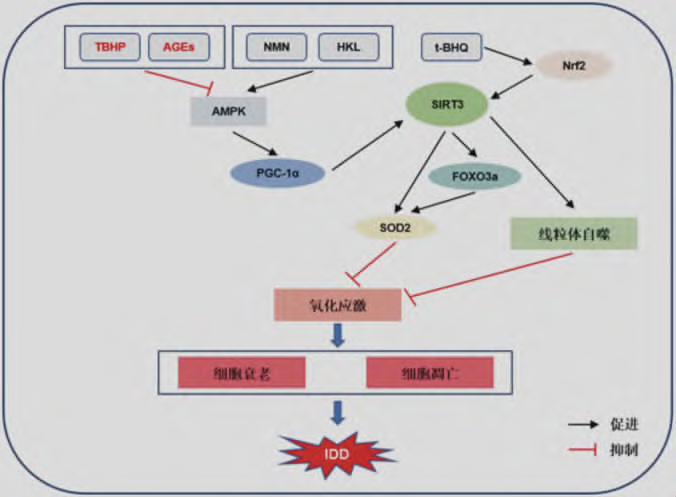
图1 SIRT3在椎间盘退变中的抗氧化机制(TBHP:叔丁基过氧化氢;AGEs:晚期糖基化终末产物;NMN:烟酰胺单核苷酸;HKL:和厚朴酚;t-BHQ:叔丁基氢醌;AMPK:AMP依赖的蛋白激酶;Nrf2:核因子E2相关因子2;PGC-1α:过氧化物酶体增殖物激活受体γ共激活因子-1α;FOXO3a:叉头框蛋白O3a;SOD2:超氧化物歧化酶2;IDD:椎间盘退变)
参考文献:略


 京公网安备11010502051256号
京公网安备11010502051256号