青年晨读会|骨肉瘤诊疗新起点
2022-04-14 我要说
来源:上海市第一人民医院、上海市骨肿瘤研究所
作者:华莹奇

骨肉瘤是有史可溯的最古老的癌症,在百万年前的古人类和几千万年前的恐龙中都发现了骨肉瘤的骨骼化石样本。
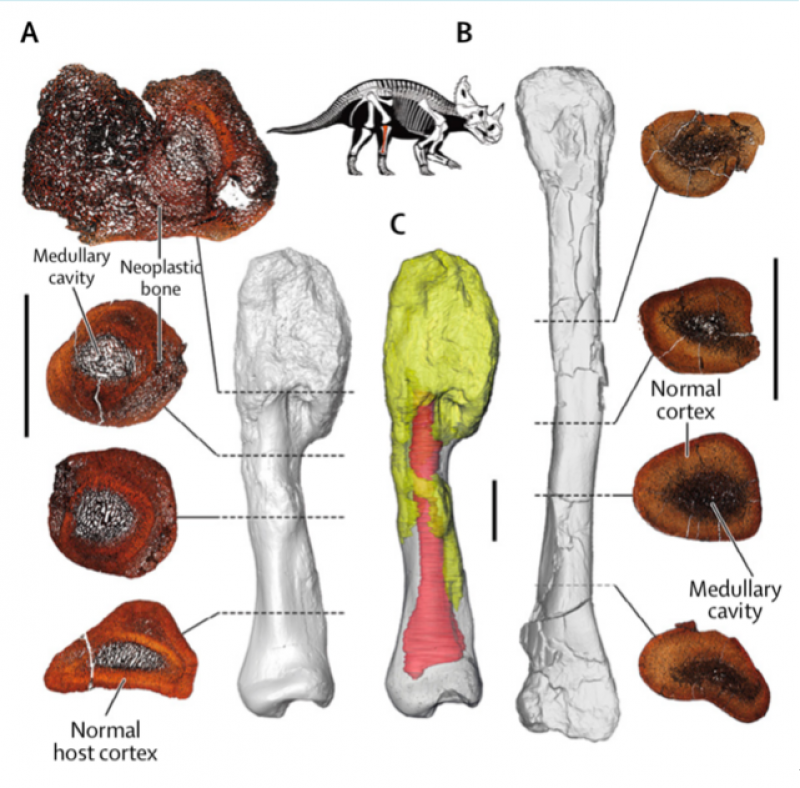
图1 在恐龙化石中发现的疑似患骨肉瘤的骨骼化石 The Lancet Oncology, Volume 21, Issue 8, 2020,
骨肉瘤是最常见的原发恶性骨肿瘤,在美国癌症统计数据中为每年800-900新发病例,在我国20岁以下的发病率约为3.7-4.5/百万,这也是疾病最好发的年龄段(数据来源WHO http://iicc.iarc.fr/results)。
无转移骨肉瘤患者5年生存率为60%左右,约10-15%的患者初诊时存在远处转移,而转移患者5年生存率只有不足20%。尽管过去的几十年以来,学术界通过各种努力尝试,骨肉瘤的生存率仍无明显提高,但是近些年来随着对其遗传学的大量研究和临床试验的发展,这个疾病的诊疗很可能将发生重大的变化。
2021年11月发表于新英格兰杂志的这篇综述,由美国NCI基因组学专家Paul S. Meltzer和骨肿瘤专家Lee J. Helman共同发表,为我们回顾现有的研究进展并提示了骨肉瘤诊疗未来可能发生的新变化,对我们开展临床和研究工作具有启迪,在此笔者与同道们分享综述中的主要精髓,也供非骨肿瘤专业的同道参考。
分期和预后
目前临床最常用的是MSTS和AJCC-UICC分期,不管哪种分期,大部分患者是MSTS IIB期或者AJCC IIA期,即高级别、间室外、无转移的骨肉瘤。预后指标方面,最有价值有术前转移灶的出现和中轴骨的原发病灶,术后为化疗坏死率及外科边界。
治疗方法的进展
自上世纪70年代以来,保肢手术联合化疗成为了治疗的主要手段,新辅助化疗有助于通过坏死率的评估来判断骨肉瘤化疗的效果。
约55%患者可以获得化疗坏死率>90%,他们的预后5年生存率约75%,化疗效果不佳,坏死率<90%的患者,5年生存率约45%,因此术前新辅助化疗现在已成为骨肉瘤的标准治疗模式,最常用的方案是MAP方案,在老年人群中,出于毒性考虑常减去MTX,而其他调整方案如添加异环磷酰胺等疗效均未能超过MAP方案。
复发、转移的治疗
初诊转移患者的治疗与无转移相同,通过新辅助化疗后,对所有病灶尽可能进行外科切除,包括肺转移灶的切除,研究表明如果能完整切除病灶,对患者生存有显著获益。挽救性的化疗方案有异环磷酰胺和依托泊苷,然而疗效有限。转移患者的长期生存率仍不足20%。
一切过往,皆为序章
骨肉瘤的治疗需要不断发展,目前骨肉瘤基因组的研究进展给我们提供了机遇,基于靶向基因的个体化医疗将为其治疗带来变化。骨肉瘤的基因组复杂性在所有肿瘤中可能是最大的,人们刚刚开始对它有所了解,而将这些信息转化为有效的治疗,需要基于驱动基因或者免疫微环境对骨肉瘤进行亚型分类,而这就需要不断优化基因检测方法和临床试验的设计。
骨肉瘤的遗传学和基因组
骨肉瘤的遗传易感性包括Li–Fraumeni综合症、遗传性视网膜母细胞瘤、DNA螺旋酶(RECQL4, WRN, and BLM)及核糖蛋白的缺陷(Diamond–Blackfan贫血)也会增加罹患骨肉瘤的风险。
体细胞突变是肿瘤的普遍特性,许多突变基因成为了成功的靶点,带来巨大的治疗进步。在骨肉瘤中,各国学者也期望通过研究获得类似的突变与靶点,自2014年起,多项全基因组(whole-genome sequencing,WGS)或(whole-exome sequencing,WES)的研究为我们越来越清晰地揭示骨肉瘤的遗传学面貌,尤其是WGS可以检测到微小的突变及结构变异,骨肉瘤的基因组变异特殊的形式包括:染色体碎裂chromothripsis,集群性突变kataegis,断裂—愈合—染色体桥循环(breakage–fusion–bridge cycles)等(图2)。
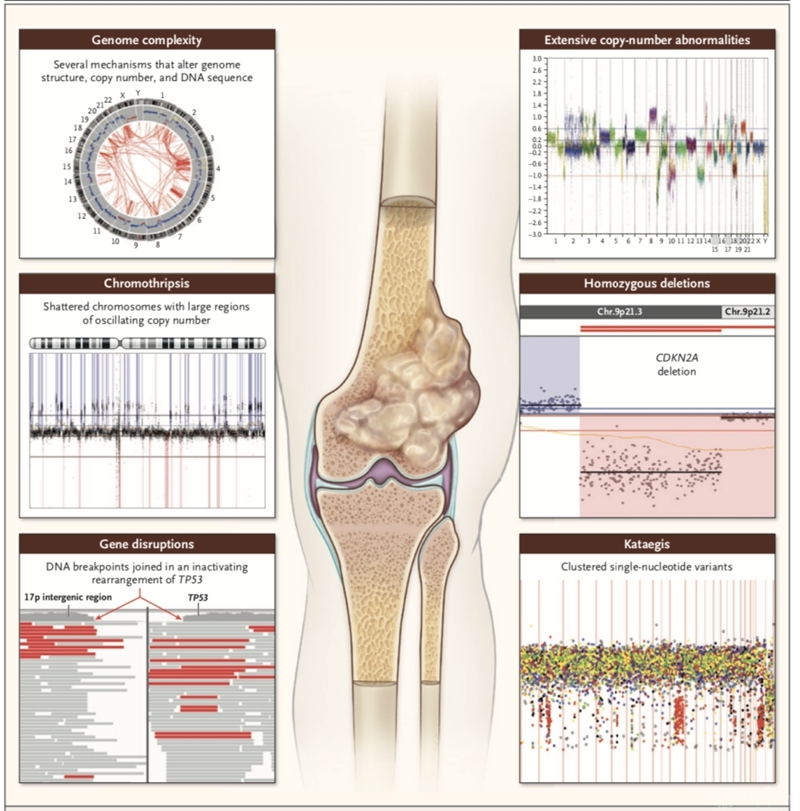
图2 骨肉瘤各类代表性基因组异常形式
拷贝数变异(Copy-number aberrations,CAN)广泛发生于骨肉瘤染色体,最高频的体细胞突变为TP53的失活,此外细胞周期调节因子CDKN2A和RB1的缺失也较常见,有时与TP53突变同时发生。这些突变导致细胞周期的失调并促进了DNA损伤累积,这些特征与其他TP53缺失肿瘤模型所类似。
然而与其他肿瘤不同,在骨肉瘤中缺乏高频的激活性致癌突变及信号通路,如激酶类。目前已发现的有PI3K-mTOR通路(PIK3CA,MTOR,and AKT1),IGF通路(IGF1R),VEGF通路(VEGFA和KDR),PDGF通路(PDGFRA),KIT通路,MYC通路,细胞周期通路pathway(CDK4,CCNE1,CCND2)。
这些靶点多且分散,而骨肉瘤的病例数少,所以需要更多的研究来为临床试验更好的筛选和验证生物标记物。MYC扩增是对预后影响最显著的基因,不久的将来会成为临床试验的候选标记物。和其他儿童癌症相比较,骨肉瘤的同源重组修复缺陷HRD较高,提示PARP抑制剂等药物可能有效。因为骨肉瘤的驱动基因变异模式以拷贝数变异为主,虽然说拷贝数扩增倍数、蛋白表达可作为选择药物的参考,但是仍不足以作为疗效预测的标记物。未来可考虑基于PDX模型的个体化药物敏感性评价筛选有效靶点。
免疫治疗
骨肉瘤的免疫治疗可追溯至1891年Coley毒素的研究,Coley医生尝试用灭活细菌治疗骨与软组织肉瘤,并取得了一些病例的成功,然而因为毒性、疗效不稳定以及当时肿瘤学的局限性,该治疗方法没能继续发展。一项回顾分析中的数据显示其对骨肉瘤是有一定的活性。

William B Coley(1862-1936)和1891年发表在Annals of Surgery上的论文
直到上世纪末,人们又对新的免疫刺激因子产生兴趣,聚焦在一种合成的细菌组分,也就是米伐木肽MTPPE。米伐木肽联合化疗将IIB期骨肉瘤的6年生存率从70%提高到78%,然而却未能获得FDA的批准,仅在欧洲及南美洲获批上市。
其他的免疫相关治疗研究包括干扰素与化疗的联用,未能获得生存获益。免疫检查点抑制剂PD-1抗体在骨肉瘤的临床试验中疗效甚微,主要原因可能是骨肉瘤免疫微环境不利于T细胞的浸润,包括微血管异常和肿瘤相关巨噬细胞TAM的干扰等,因此需要其他联合手段创造更有利于T细胞杀伤的免疫微环境。
细胞治疗方面,针对骨肉瘤的CAR-T靶点有HER2、GD-2;TCR-T有MAGE-A3,报道了一例PR的患者。此外抗体药物偶联ADC类的药物用于骨肉瘤也在临床试验阶段,靶点有LRRC15等。
发展道路
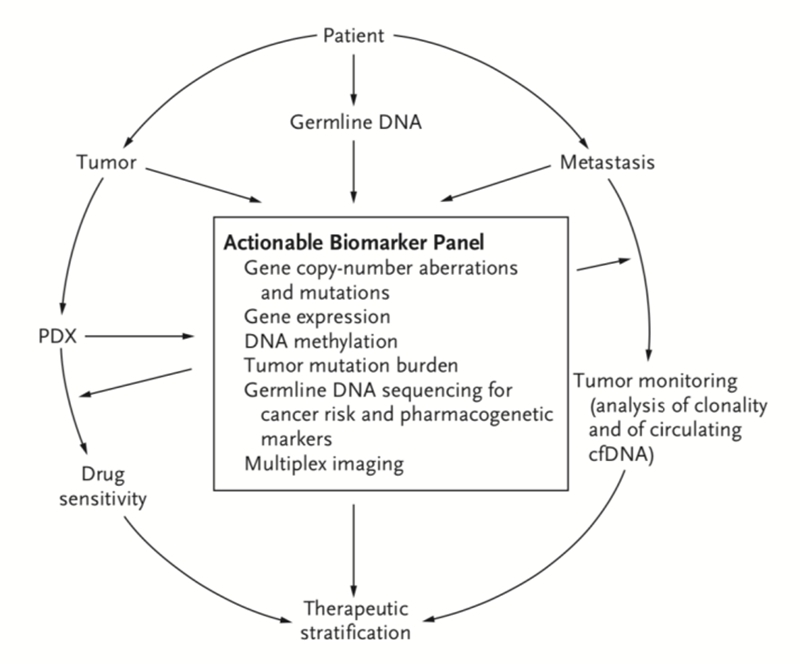
图3 基于分子信息的骨肉瘤精准医学路径
多年以来,相较其他实体瘤,骨肉瘤疗效没有明显的提高,主要有以下几点关键因素:一是对预后不佳的患者没有敏感的指标将其进行亚型分类,二是对其免疫微环境特征了解还不多,三是其复杂的基因变异模式限制了药物靶点的开发。
此外临床研究方面也有两个制约因素:其一是样本量小,发病率本身较低而60%的5年生存率意味着剩下需要干预进展期患者的量更少,如果是针对初诊患者的新疗法,以60%的OS作为对照,则需要更大的样本量;其二,作为评判临床试验疗效的标准,RECIST标准对骨肉瘤来说并不完全适用,RECIST标准是以影像学瘤体的缩小为评价指标,而骨肉瘤内部的肿瘤成骨生物学特征会限制体积的缩小。
在一项临床观察中,74例初诊骨肉瘤患者,5年随访的PFS和OS分别为77%和61%,然而没有一例患者影像学能达到RECIST标准的客观缓解(CR或PR)。因此经过多项临床试验结果的综合分析,学界提出了以进展期患者PFS>4m或早期患者EFS>12m作为骨肉瘤临床试验(单臂)中判断药物活性及值得进一步开展研究的基准值。
小结和展望
直到今天,骨肉瘤仍依赖于MAP方案,诞生于还没有严格临床试验标准的几十年前,随着基因组学的进展,我们知道骨肉瘤的基因变异特征包括染色体倍增、chromothripsis和kataegis等,然而仍未能聚焦某些有效的靶点,未来的临床试验需要更精准的分型和更敏感的预后标志,仍需要对骨肉瘤免疫微环境进行更多的解析,同时需要对临床试验的设计进行优化。
参考文献:
Paul S. Meltzer, M.D., Ph.D., and Lee J. Helman, M.D. New Horizons in the Treatment of Osteosarcoma. N Engl J Med 2021; 385:2066-2076
文献解读人

华莹奇
上海交通大学附属第一人民医院骨科,副主任医师、副教授、副研究员、硕士生导师。
担任上海市骨肿瘤研究所副所长;上海市医学会骨科学分会骨肿瘤学组副组长;中国抗癌协会肉瘤专业委员会常委、基础研究与转化学组组长;中华医学会骨科学分会骨肿瘤学组青年委员;CSCO肉瘤专业委员会委员;CTOS、ISOLS会员,国际华人骨研学会ICMRS青年委员;上海市青年拔尖人才。
获中华医学科技进步一等奖、教育部科技进步一等奖等奖项;获国家自然科学基金、科技部重点研发计划等项目8项;在骨肿瘤基础及临床研究领域发表SCI论文50余篇。





 京公网安备11010502051256号
京公网安备11010502051256号