新进展|BMP在脊柱融合应用中的并发症
2021-04-13 文章来源:大连医科大学附属第一医院骨科 作者:张文涛 李忠海 我要说
作者:张文涛 李忠海
单位:大连医科大学附属第一医院骨科
自体骨移植物具有天然的骨诱导性和骨传导性,是骨移植材料中的金标准,但因其存在来源有限,取骨处疼痛等弊端,研制出新型骨修复材料成为了目前亟待解决的问题。
骨形态发生蛋白(bone morphogenetic proteins,BMPs)是一组具有骨诱导活性的细胞因子,属于转化因子超家族。在已发现的10余种BMP中,BMP-2成骨能力较强,但其含量有限且分离提纯成本高,因此临床上更多使用人重组骨形态发生蛋白-2(recombinant human bone morphogenetic protein-2,rhBMP-2),但目前rhBMP-2应用范围远超其标准,并出现了很多并发症。
电镜显示的BMPs结构
BMPs是从脱钙骨基质中提取出来的可以定向诱导间充质细胞分化为成骨细胞的蛋白质,并具有诱导软骨和骨异位分化的能力。BMPs通过与丝氨酸/苏氨酸受体结合发挥作用,提高碱性磷酸酶和甲状旁腺激素水平,从而增加骨钙蛋白的表达。当与间充质干细胞上的跨膜受体结合后,BMPs诱导其分化成为骨祖细胞并形成新骨。
rhBMP-2具有与BMP-2相似的诱导成骨特性,同时rhBMP-2诱导成骨时间早,成骨量多,且生物活性、生物相容性良好。脊柱融合动物模型研究显示局部应用rhBMP-2后整个融合过程中细胞因子的表达存在显著差异,其中IL-6和IL-1RA高表达,而生长因子表达似乎被抑制,升高的IL-6可能是rhBMP-2诱导的骨空隙中新骨和多余脂肪组织形成的原因。
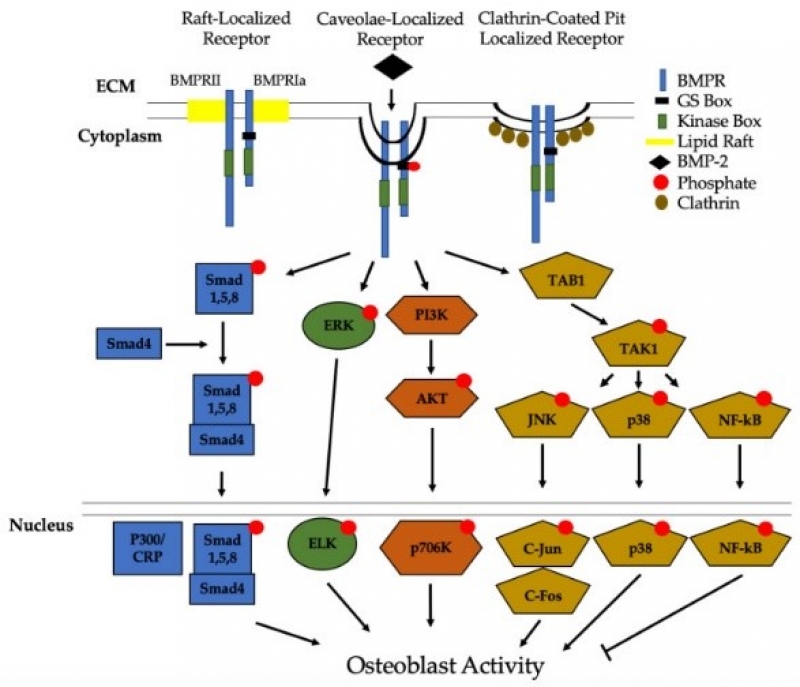
BMP-2激活成骨细胞活性的相关信号通路
rhBMP-2在2002年得到FDA的批准,应用于腰椎前路椎间融合术中,目前已广泛应用其他脊柱融合术中,包括腰椎后外侧融合、腰椎经椎间孔椎体间融合和颈椎融合等,并且获得了很高的融合率,但相关的并发症也随之发现。
Lee等1对比了rhBMP-2组与多能成体祖细胞(map3)组术后的影像学结果和临床效果,发现rhBMP-2组并发症发生率高于map3组。
Esmail等2回顾性分析了接受后/后外侧腰椎融合术患者并发症的发生情况,发现rhBMP-2组患者并发症发生率更高,同时还发现rhBMP-2相关并发症可能与性别相关。
Khajavi等3随访了72例接受颈椎前路融合术并予以低剂量rhBMP-2治疗的患者,其中3例出现严重并发症(骨不连、血肿、喉返神经损伤)。
Weisbrod等4研究了26例患者术后的影像学资料,观察到在所有患者中都存在rhBMP-2的特征表现(椎前软组织肿胀和早期终板再吸收),同时也发现了聚醚醚酮笼沉降、移位,异位骨形成等影像学表现。
Zadegan等5甚至不建议在颈椎前路手术中使用rhBMP-2,因其分析发现尽管使用rhBMP-2可提高融合率,但致命并发症的发生风险也增高。
临床中需要使用高浓度rhBMP-2以实现骨形成,主要并发症可分为以下5类:过度生长和不受控制的骨形成;早期骨溶解,移植物沉降、移位;局部炎症、水肿,伤口感染;神经系统事件、逆行射精/持续膀胱潴留、早期腰腿痛、神经根炎和功能丧失等;致癌性。
1.过度成骨
rhBMP-2相关的公认并发症是异位骨的形成,其发生与rhBMP-2渗漏有关,一旦发生渗漏,形成异位骨的几率约为对照组的6倍,同时CT结果显示,rhBMP-2组异位骨发生率为70.1%,而对照组仅为12.9%。其主要担忧为过度成骨导致椎间融合,进而出现神经症状。
2.早期骨溶解,移植物沉降、移位
Vaidya等6进行了一项前瞻性研究,发现尽管rhBMP-2组融合率高达100%,但在18例使用rhBMP-2的颈椎手术中,6例患者发生了明显的移植物下沉。
Klimo等7研究发现,在颈椎前路融合术中rhBMP-2组中度或重度终板溶解发生率高达57%,最终将导致移植物沉降和移位。
脊柱融合手术中使用rhBMP-2的患者出现了不同程度的椎体溶解和骨吸收现象,其发生与BMP相关的破骨细胞激活有关。有学者提出,rhBMP-2相关并发症的发生可能与终板破坏或rhBMP-2过量使用有关。
Balseiro和Nottmeier8研究同样发现过量使用rhBMP-2可导致椎体溶解,同时发现术前CT所显示的软骨下囊肿可能增加椎体溶解发生的风险。
3.局部炎症、水肿、伤口感染
颈椎前路手术中使用rhBMP可出现严重并发症,其发生主要与颈部肿胀有关。
Shields等9研究显示接受rhBMP大剂量治疗后,23.2%患者出现了明显的并发症。颈部软组织肿胀,可造成患者术后吞咽困难和呼吸困难等。
Smucker等10报道了rhBMP-2组颈部肿胀的发生率高达27.5%,远远高于对照组。然而也有研究显示在多节段融合术中即使不使用rhBMP,仍存在颈前水肿的风险。
Lu等11提出了不同的观点,其发现接受2节段融合术的患者使用rhBMP-2可显著增加吞咽困难的严重程度,但不影响发生率,然而接受3节段或4节段融合术的患者发生率和严重程度与同种异体移植物组相似,对于接受4节段融合术的吸烟患者,使用rhBMP-2可降低假关节的发生率。
Kukreja等12观察了197例术中使用低剂量rhBMP-2患者的并发症,结果显示17例患者出现颈部水肿,26例患者出现吞咽困难等,作者表明在颈椎前路手术中使用低剂量rhBMP-2并非没有风险,且剂量与并发症的发生率及严重程度密切相关。
Lovasik等13回顾性分析比较了分别使用rhBMP-2与-磷酸三钙的融合情况和并发症发生情况,结果发现rhBMP-2组融合率更高,但吞咽困难症状更加严重。
Robin等14发现了在颈椎部位使用rhBMP-2后可出现血肿,继而导致双侧上肢感觉异常,同时发现血清中炎性细胞因子水平升高。
Wanderman等15报道了2例使用rhBMP-2后血肿形成的病例,表明rhBMP-2存在血肿形成的相关风险,建议外科医生对术后出现症状的患者即行MRI检查。
Takahashi等16研究表明,仅在下颈椎融合时,rhBMP-2可能会增加伤口相关并发症的发生率。
4.神经系统相关并发症
有研究显示,rhBMP-2在颈椎后路手术中并未增加并发症的总发生率,但会增加复发/持续性颈部疼痛的发生率。
Mindea等17研究表明,其相关并发症的发生可能与手术方式相关,其发现微创术中使用rhBMP-2的患者神经根症状发生率更高。术后神经根炎的发生往往是由于炎症反应,少数也可由局部压迫形成。
有学者研究发现,硬膜外的渗漏将导致异位骨形成并相互碰撞,进而引起神经根压迫,rhBMP-2组术后神经根炎发生率为14%,而对照组只有3%,同时作者提出在环切术部位使用薄层水凝胶密封剂可降低神经根炎的发生率18。
Villavicencio等19分析了剂量与神经根炎发生率之间的关系,未发现剂量相关性,但rhBMP-2剂量的较大变异可能是神经根炎发生的相关因素。在腰椎融合手术中,rhBMP-2组逆行射精的发生率远远高于对照组。发生逆行射精的最常见原因是主动脉分叉处上腹下神经丛的机械性或炎性损伤。
Comer等20回顾性比较了在术中接受与未接受rhBMP-2治疗的男性患者逆行射精的发生率,结果显示rhBMP-2组较对照组逆行射精和尿潴留发生率高,同时他们还发现,前列腺肥大症将增加出现逆行射精的风险。
Carragee等21研究也证实了使用rhBMP-2可导致较高的逆行射精发生率,这也可能是患者术后不育的一个重要因素。
5.致癌性
基础生物研究表明,BMP与乳腺癌、肺癌等多种肿瘤的发生、发展有关。
有学者发现,曾接受rhBMP-2治疗的患者癌症发生率高于自体移植物组。但Cooper和Kou等22研究分析表明,术中是否给予rhBMP-2治疗与后续癌症风险的增加无关。
Dettori等23提出相对有限的随访时间是限制rhBMP和癌症相关关系研究的因素之一,rhBMP给药后癌症发病率的检查必须超过最初几年,这样才能充分评估rhBMP与恶性肿瘤之间的关系。
目前临床研究显示出互相矛盾的实验数据,有研究表明rhBMP-2具有前恶性肿瘤效应,也有研究表明rhBMP-2对肿瘤有抑制作用。目前仍需要进一步的临床研究来明确rhBMP-2与肿瘤的关系。
小结
目前,rhBMP-2已被用于多个领域,包括颈椎和腰椎融合、畸形矫正和骨髓炎治疗等。随着rhBMP-2相关临床经验的增多,许多潜在的不良事件被阐述。
研究者试图研究最佳剂量、最佳载体和最佳应用位置等来增强rhBMP-2的成骨性的同时,减少相关并发症的发生。临床中还存在一些因素对融合率及并发症发生率存在影响。
有研究表明,吸烟可作为应用rhBMP-2后出现假关节、器械失败和邻近节段再次手术的最强预测因子。rhBMP-2的使用促进了骨生物学研究,尽管过去几十年对其进行了大量研究,但仍需进一步的基础和临床研究来评估其长期临床效果。
部分内容来自:李奭慧,李忠海.人重组骨形态蛋白-2在脊柱融合中并发症的研究.生物骨科材料与临床研究,2020,17(03):55-58.
参考文献:
[1] Lee DD, Kim JY. A comparison of radiographic and clinical outcomes of anterior lumbar interbody fusion performed with either a cellular bone allograft containing multipotent adult progenitor cells or recombinant human bone morphogenetic protein-2[J]. J Orthop Surg Res, 2017, 12(1): 126-133.
[2] Esmail N, Buser Z, Cohen JR, et al. Postoperative complications associated with rhBMP2 use in posterior/posterolateral lumbar fusion[J]. Global Spine J, 2018, 8(2) 142-148.
[3] Khajavi K, Shen A. Safety and efficacy of bioabsorbable cervical spacers and low-dose rhBMP-2 in multi-level ACDF [J]. Int J Spine Surg, 2014, 8: 9-19.
[4] Weisbrod LJ, Arnold PM, Leever JD, et al. Radiographic and CT evaluation of recombinant human bone morphogenetic protein-2-assisted cervical spinal interbody fusion[J]. Clin Spine Surg, 2019,32(2):71-79.
[5] Zadegan SA, Abedi A, Jazayeri SB, et al. Bone morphogenetic proteins in anterior cervical fusion: A systematic review andMetaanalysis[J].World Neurosurg, 2017, 104: 752-787.
[6] Vaidya R,Weir R, Sethi A,et al. Interbody fusion with allograft and rhBMP-2 leads to consistent fusion but early subsidence [J]. J Bone Joint Surg Br, 2007, 89(3): 342-345.
[7] Klimo P, Peelle MW. Use of polyetheretherketone spacer and recombinant human bone morphogenetic protein-2 in the cervical spine: a radiographic analysis[J]. Spine J, 2009, 9(12): 959-966.
[8] Balseiro S, Nottmeier EW. Vertebral osteolysis originating from subchondral cyst end plate defects in transforaminal lumbar interbody fusion using rhBMP-2. Report of two cases[J]. Spine J,2010, 10(7): 6-10.
[9]Shields LB, Raque GH, Glassman SD et al. Adverse effects associated with high-dose recombinant human bone morphogenetic protein-2 use in anterior cervical spine fusion[J].Spine (Phila Pa 1976), 2006, 31(5): 542-547.
[10] Smucker JD, Rhee JM, Singh K, et al. Increased swelling complications associated with off-label usage of rhBMP-2 in the anterior cervical spine[J]. Spine, 2006, 31(24): 2813-2819.
[11] Lu DC, Tumialan LM, Chou D. Multilevel anterior cervical discectomy and fusion with and without rhBMP-2: A comparison of dysphagia rates and outcomes in 150 patients[J]. J Neurosurg Spine, 2013, 18(1): 43-49.
[12] Kukreja S, Ahmed OI, Haydel J, et al. Complications of anterior cervical fusion using a low-dose recombinant human bone morphogenetic protein-2[J]. Korean J Spine, 2015, 12(2): 68-74.
[13] Lovasik BP, Holland CM, Howard BM, et al. Anterior cervical discectomy and fusion: Comparison of fusion, dysphagia, and complication rates between recombinant human bone morphogenetic protein-2 and beta-tricalcium phosphate [J].World Neurosurg, 2017, 97: 674-683.
[14] Robin BN, Chaput CD, Zeitouni S, et al. Cytokine-mediated inflammatory reaction following posterior cervical decompression and fusion associated with recombinant human bone morphogenetic protein-2: A case study[J]. Spine (Phila Pa 1976),2010, 35(23): 1350-1354.
[15] Wanderman NR, Drayer NJ, Tomov M, et al. Postoperative seroma formation after posterior cervical fusion with use of rhBMP-2: A report of two cases[J]. JBJS Case Connect, 2018, 8(3): 74-79.
[16] Takahashi S, Buser Z, Cohen JR, et al. Complications related to the recombinant human bone morphogenetic protein 2 use in posterior cervical fusion[J]. Clin Spine Surg, 2017, 30(9): 1269-1273.
[17] Mindea SA, Shih P, Song JK. Recombinant human bone morphogenetic protein-2-induced radiculitis in elective minimally invasive transforaminal lumbar interbody fusions: A series review [J].Spine (Phila Pa 1976), 2009, 34(14): 1480-1484.
[18] Rihn JA, Patel R, Makda J, et al. Complications associated with single-level transforaminal lumbar interbody fusion[J]. Spine J,2009, 9(8): 623-629.
[19] Villavicencio AT, Burneikiene S. RhBMP-2-induced radiculitis in patients undergoing transforaminal lumbar interbody fusion:Relationship to dose[J]. Spine J, 2016, 16(10): 1208-1213.
[20] Comer GC, Smith MW, Hurwitz EL, et al. Retrograde ejaculation after anterior lumbar interbody fusion with and without bone morphogenetic protein-2 augmentation: A 10-year cohort controlled study[J]. Spine J, 2012, 12(10): 881-890.
[21] Carragee EJ, Mitsunaga KA, Hurwitz EL, et al. Retrograde ejaculation after anterior lumbar interbody fusion using rhBMP-2:A cohort controlled study[J]. Spine J, 2011, 11(6): 511-516.
[22] Cooper GS, Kou TD. Risk of cancer following lumbar fusion surgery with recombinant human bone morphogenic protein-2(rhBMP-2): An analysis using a commercially insured patient population[J]. Int J Spine Surg, 2018, 12 (2): 260-268.
[23] Dettori JR, Chapman JR, DeVine JG, et al. The risk of cancer with the use of recombinant human bone morphogenetic protein in spine fusion[J]. Spine (Phila Pa 1976), 2016, 41(16): 1317-1324.
作者简介:

张文涛
大连医科大学硕士研究生,导师:李忠海教授。主要研究方向:骨修复材料。

李忠海
大连医科大学附属第一医院骨科,副教授,医学博士,博士后,硕士研究生导师,“兴辽英才计划”青年拔尖人才,大连青年科技奖获得者。
研究方向:脊柱退行性疾病发病机理与修复再生机制研究、活性骨修复材料、骨科数字化与人工智能。
目前兼任中国研究型医院学会神经再生与修复专业委员会脊柱退行性变与神经保护学组组长、ISESS国际脊柱内镜外科学会委员、中华医学会骨科学分会创新与转化学组青年委员、中国康复医学会脊柱脊髓专业委员会基础研究学组委员、中国康复医学会颈椎病专业委员会基础学组委员、中国医促会骨科分会骨科生物材料学组委员、中国生物材料学会骨修复材料与器械分会委员、中华中医药学会脊柱微创专家委员会委员、中国老年学和老年医学学会骨质疏松分会脊柱微创学组委员、中国医药生物技术协会3D打印技术分会委员、白求恩公益基金会骨科基层教育委员会委员等。主持国家、省部级科研课题基金项目7项。第一/通讯作者发表SCI论文40篇,累计IF超100。国家发明/实用新型专利授权8项。第1完成人获大连市科技进步奖二等奖及三等奖、日内瓦国际发明展银奖、辽宁省自然科学学术成果奖二等奖等。





 京公网安备11010502051256号
京公网安备11010502051256号