失去日常生活能力的平山病孩子
2021-03-10 文章来源:复旦大学附属华山医院 美国上州大学医学院 我要说
失去日常生活能力的平山病孩子
——运用运动单位指数(MUNIX)定量评估近端型平山病患者的运动障碍和手术预后
郑超君a,朱愈b,郁奇峰a,朱冬青a,吕飞舟a,Robert Weberb,乔凯a,姜建元a
a 复旦大学附属华山医院
b 美国上州大学医学院
摘要
目的 探讨运动单位数目指数(motor unit number index, MUNIX)定量评估近端受累型平山病的可行性,并探讨颈椎前路融合内固定手术(anterior cervical fusion, ACF)治疗近端型平山病的有效性。
方法 本研究共纳入41例平山病患者(近端型:远端-近端型=7∶34)和41例健康志愿者。所有的41例患者术前及术后1年进行了DASH评分,MRC肌力测定;其中28例患者完成了拇短展肌(abductor pollicis brevis, APB)、小指展肌(abductor digiti minimi, ADM)、肱二头肌(biceps brachii, BB)和三角肌(deltoid, DEL)的MUNIX检测。
结果 近端合并远端组患者术前双侧上肢远端及症状侧近端肌肉的CMAP及MUNIX降低,而MUSIX增加(P<0.05),而近端型患者的小指展肌、肱二头肌及三角肌也获得了类似的结果(P<0.05)。术后随访中,近端型平山病患者存在症状侧近端肌力及运动功能的恢复(P<0.05),而近端合并远端型的患者存在症状侧近端肌肉CMAP和MUSIX的恢复(P<0.05)。
结论 MUNIX是一种可行的、可定量评估累及近端的平山病患者运动功能障碍和手术预后的方法;而颈椎前路融合手术(ACF)对于近端累及的平山病患者有效,且对近端肌肉起病的患者疗效更好。
1 引言
青少年上肢远端肌萎缩症最初由日本学者平山惠造在1959年报道,并被以他的名字命名[12]。平山病是一类局限性的,多发于男性的疾病,通常表现为单侧上肢或不对称的C7-T1支配的手内在肌或前臂肌无力或肌萎缩[21]。
虽然平山病在亚洲较为常见,但过去的20年间,亚洲以外地区的病例报道数明显增多[21],而Ghosh研究中的病例均在发病初期被误诊[8]。因此,平山病在西方国家可能并不是一种罕见病,对该疾病认识的深入对西方读者同样有着重要意义。
目前平山病的病理生理机制尚不明确。目前影像学及电生理的研究均认为平山病的发病原因可能和颈椎屈曲导致的脊髓慢性缺血或脊髓前角细胞损伤有关[8,14,16,25,33],而下颈椎后方硬膜在屈颈时前移可能和“颈脊髓与硬膜囊生长速率不匹配”“硬膜囊和椎弓根的分离”“后方硬膜外韧带的因素”“神经根发育不良”“颈椎硬膜的弹性和胶原纤维的病理性异常”等相关。
因此,佩戴颈托来限制颈椎活动来治疗平山病被广泛使用[11,16]。而近来发布的临床指南指出了手术治疗平山病,尤其是无法难受长时间佩戴颈托的患者的有效性[21]。
随着平山病病例数的增多,越来越多的累及近端肌群的平山病被报道[1,18,26,32]。先前的研究指出约5~10%的平山病患者存在上肢近端肌肉的累及(如三角肌,肱二头肌等)[10,15,31]。然而,对于存在累及近端肌群的平山病患者的手术预后研究较少,因此相关研究对于近端累及的患者的治疗方案制定具有重要意义。
MUNIX(motor unit number index,运动单位数目指数)是一种评估近端或远端肌肉功能性运动单位数目和大小的定量方法[7,22]。不同于MUNE选择性检测I型运动单位,MUNIX的测定依赖于等长收缩下的CMAP波幅和体表肌电图的干涉图样(surface EMG interference pattern, SIP)[22]。
MUNIX同时记录了I型运动单位和II型运动单位。除此之外,MUNIX可以用来预测被测肌肉的功能性运动单位数目,而运动单位电位(MUP)分析主要用来评估运动单位电位的时程、强度等[18]。因此,MUNIX可用来评估运动单位快速丢失或暂时抑制且没有侧枝代偿的疾病[6]。
不同于其他两种量化评估的方法,MUNIX是一种无创技术,从而能够提高患者的依从性。近期发表的研究证实MUNIX对于神经肌肉疾病中运动神经元丢失和传导阻滞具有较高的敏感性[2,9,24,37,39],而前者已被证实是平山病患者的主要病理过程[13]。
因此,本研究的主要目的在于测定存在近端肌群累及的平山病患者近端和远端肌肉的功能性运动单位数目,结合临床功能量表,比较颈椎前路融合内固定术对运动单位数目及临床功能评分的影响。
2 方法与材料
2.1 患者信息
从2007年8月至2019年12月,我院明确诊断约760例平山病患者,其中426例接受了颈椎前路手术(ACF)。通过纳入及排除标准共纳入41例存在近端肌累及的患者(图1,图2)。
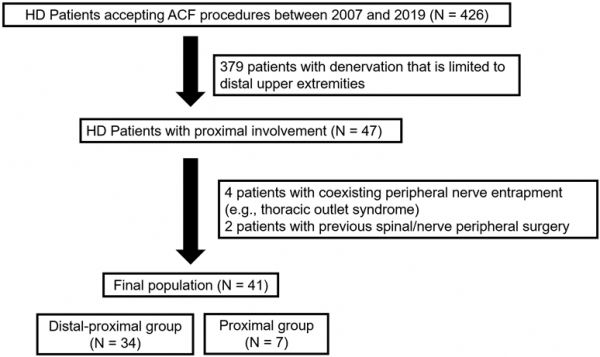
Fig1 本研究的纳入对象。HD:Hirayama Disease,平山病;ACF:Anterior Cervical Fusion,颈椎前路融合手术;N,Number
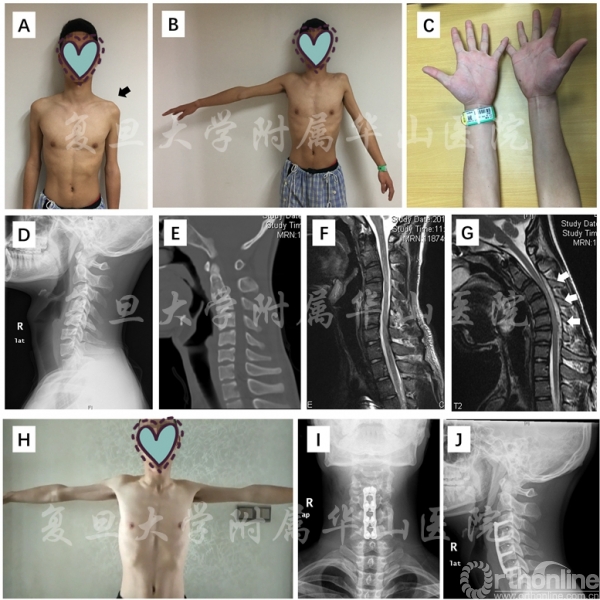
Fig2 一例通过颈椎前路融合内固定手术治疗的近端组平山病患者 A-B:左侧近端肌肉存在显著的肌无力和肌萎缩(黑色箭头);C:双上肢远端无明显肌无力或肌萎缩;D-E:颈椎X光及CT均提示颈椎前凸曲度的丢失;F-G:在MRI中,颈椎中立位未见明显异常,屈颈位可见后方硬膜囊前移及“新月形”流空影(白色箭头);H:患者术后运动功能较前改善;I-J:患者接受了C3-4,C4-5及C5-6三节段的融合
根据患者肌萎缩起病,将症状起自近端肌肉的纳入近端组,而症状其自远端肌肉的纳入远端-近端组(表1)。同时,本研究纳入了我们之前其他研究中的69例没有近端肌肉累及的远端组患者以及41名健康志愿者[36,37]。
我们之前的研究也已经描述了颈椎前路手术(ACF)的方法[36]。该研究通过了复旦大学附属华山医院伦理委员会的认定,且所有患者签署了知情同意书。
该研究的纳入标准:
(1)25岁前出现隐匿性起病;
(2)无感觉功能障碍或下肢受累的单侧或不对称的上肢无力和肌萎缩,包括C5和/或C6肌节受累;
(3)ACF手术史;
(4)诊断为平山病,不伴有任何其他原因的脊髓病。
排除标准为:
(1)局限于上肢远端的失神经改变;
(2)既往接受过脊髓或周围神经手术;
(3)脊髓空洞症;
(4)周围血管疾病;
(5)肌肉疾病;
(6)颈椎病伴肌萎缩;
(7)运动神经元疾病;
(8)神经肌肉接头的原发性或伴随性疾病;
(9)中枢神经系统疾病;
10)脊髓肿瘤/畸形/创伤/感染;
(11)存在其他可能影响周围神经功能的疾病。
本研究中C5/6腹侧神经根和前角细胞损伤的半段方法如下:针肌电图检查中可见大于等于2块及以上相关肌肉自发纤颤电位/正锐波/重复放电等,伴或不伴C4-6椎旁肌受累。
2.2 检测方法
MUNIX:存在近端累及的41例患者中,28例患者在术前及术后平均12.6±2.2月接受了MUNIX测定。所有的电生理相关检查使用Keypoint肌电图仪(version2.32; Medtronic Dantec, Skovlunde, Denmark),同时保持皮肤温度32℃。同时,为排除检查者影响,所有检查均由同一检查者完成。
记录双侧拇短展肌(abductor pollicis brevis, APB)、小指展肌(abductor digiti minimi, ADM)、肱二头肌(biceps brachii, BB)和三角肌(deltoid, DEL)的最大CMAP波幅(滤波器:3Hz-10kHz)(图3),本研究中的电极放置位置详见既往研究[27,38]。
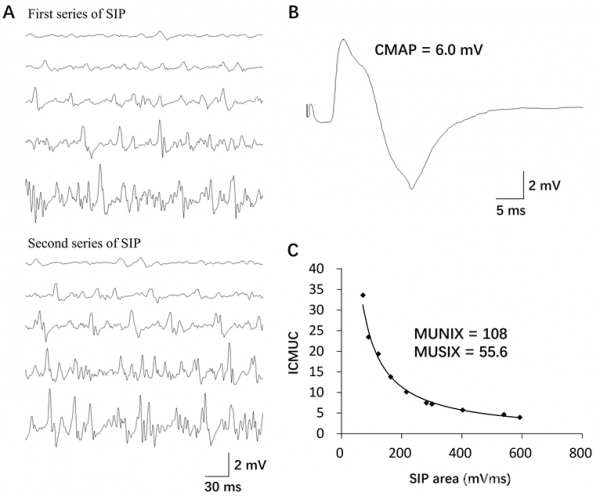
Fig3 上肢近端肌MUNIX的计算方法 A:在300ms窗宽下,记录两次肱二头肌在五种不同等长收缩强度(≤10%,25%,小于最大,最大收缩)下的SIP值;B:远端-近端组患者肱二头肌的最大CMAP波幅;C:ICMUC和SIP面积的回归曲线。ICMUC:理想状态下的运动单位技术;CMAP:混合肌肉动作电位;SIP:肌电图表面干扰模式
使用大小约15*20mm表面电极在肌腱处放置记录电极,使用手持刺激器作为刺激电极(肱二头肌:刺激锁骨上窝,胸锁乳突肌后方;三角肌:刺激Erb点;拇短展肌:在桡侧腕屈肌及掌长肌肌腱之间中点;小指伸肌:手腕内侧刺激,靠近尺侧腕屈肌)。接地电极放置在手持刺激器和记录电极之间。
同时,选择在多个位置调整刺激电极位置以获得最大的CMAP波幅。随后,间隔300ms记录两组SIP(图3A)(滤波器:10Hz-1000Hz)。
根据测得的CMAP和SIP,通过Excel表计算MUNIX值。并通过公式:MUSIX=CMAPmax/MUNIX计算MUSIX值。为了避免其他肌肉的影响,以下任一情况发生时MUNIX不能计算:SIP面积小于20mV·ms,理想运动单位计数(ideal case motor unit count, ICMUC)大于100,SIP面积/CMAP面积小于1,或CMAP强度小于0.5mV时。
2.3 临床功能评估
所有41例患者在术前及术后平均12.5±2.4月完成了DASH评分并根据MRC量表记录了患者的肌力测定。
2.4 统计学方法
所以用SPSS22.0(IBM, Armonk, NY)完成数据分析。使用K-S检验正态分布。患者组和健康组使用单因素方差分析和Kruskal-Wallis H检验(最小显著性差异检验)进行比较,并使用相同方法对近端型,远端-近端型和远端型患者进行比较。远端-近端型患者与近端型患者采用独立T检验或Mann-Whitney检验进行比较,使用配对T检验或Wilcoxon秩和检验对患者手术前后进行比较。采用Pearson或Spearman相关分析评价MUNIX值与临床功能量表的关系。P<0.05被认为存在统计学差异。
3 结果
在本研究中,41例患者(41/426,9.6%)表现出C5和(或)C6神经根支配的近端肌肉的受累,而其中7人最早在近端肌肉出现临床症状(表1)。在其他34例(34/41,82.9%)远端起病的患者中,11例患者病程≥4年,而其中的7人(7/11,63.%)在第二次进展期(平台期数月或数年后出现的快速进展)。
术前,相较于健康对照组,远端-近端组患者出现双侧ADM和APB的CMAP波幅降低,MUNIX值降低以及MUSIX值增大(P<0.05,表2),而上述患者症状侧BB及Del的MUNIX值也出现了相同的改变(P<0.05,表2)。而近端组患者相较于健康对照组出现了近端肌肉及远端ADM的CMAP波幅降低,MUNIX值降低及MUSIX增大(P<0.05,表2)。此外,远端-近端组患者上肢远端及近端BB的MRC分值出现明显降低(P<0.05,表2),而近端组患者出现了症状侧ADB,BB和Del的MRC分值降低(P<0.05,表2)。
存在近端累及的平山病患者中,症状侧DASH评分和MUNIX值存在明显负相关(APB∶r=-0.39; Del∶r=-0.50; BB∶r=-0.52; P<0.05);MRC分值和MUNIX值在双侧均存在部分正相关(症状较重侧:ADM∶r=0.76; APB∶r=0.73; Del∶r=0.49; BB∶r=0.43。症状较轻侧:ADM∶r=0.65; APB∶r=0.71, P<0.05)。
远端-近端组术前与术后的双上肢MRC分值及DASH评分均无显著差异(P>0.05,表3);而近端组患者术后出现症状侧Del的MRC分值增加及DASH评分的降低(P<0.05,表3)。近端组症状侧BB和Del的CMAP波幅,MUNIX及MUSIX值术后均出现了明显增加(P<0.05,表4)。在远端-近端组,症状侧BB和Del的CMAP波幅及MUSIX出现了显著的增加(P<0.05,表5)。
4 讨论
在本研究中,约1/10的平山病患者存在近端肌肉累及,而该部分患者的3/4于上肢远端起病。既往的研究也提出过类似结果[19],并认为近端肌肉的累及可能是平山病患者经过长期反复颈椎屈曲导致。
Shao等的研究提出“膜壁分离”可能和平山病患者近端及远端运动功能障碍进展有关[28]。更重要的是,许多远端-近端组患者出现近端累及前病程超过4年,这符合近期较多研究所提出的平山病可能没有自限性或需要更长的时间才会停止进展的观点[5,20,35]。
根据之前的研究,对典型的平山病患者采用两节段的颈椎前路融合内固定手术可能会造成相邻节段的退变,尤其是对于年轻的患者[36]。表1中也指出仅1.5%典型的平山病患者(远端组)采用两节段以上的颈椎融合手术,而这一占比明显低于远端-近端组患者。这可能和患者长期屈颈造成的颈椎结构性异常有关(如颈椎前凸消失,“膜壁分离”等)[28]。
因此,早期治疗,尤其是手术治疗,可能能够减少上肢远端运动单位的丢失,同时避免上肢近端的累及,进而减少手术需要融合的节段。
另一个造成平山病上肢近端受累的原因可能是神经根的发育不良。相较于颈椎和颈脊髓的发育失平衡,近来的研究认为受到缩短的神经根牵拉可能是造成屈颈时脊髓前移的原因之一[29,34],而神经根张力的增高可能和平山病的病理改变相关,这一假说也受到了既往尸体解剖研究的支持[13]。
因此,近端累及的平山病患者,其病理生理机制,相较于缺血造成的脊髓前角细胞损伤,可能和神经根牵拉更为相关。而我们知道C5神经根是最短的颈神经根,而这也能解释该部分患者上肢近端起病的原因。
根据表2,平山病患者同一肌肉MUNIX值的下降比例大于CMAP波幅的下降,部分肌肉甚至在CMAP波幅正常的情况下出现了MUNIX值的异常。这可能和剩余运动单位的侧枝神经支配相关,而MUSIX值的增加也提示了“神经再支配”的存在。因此,在平山病早期,相较于CMAP波幅,MUNIX作为运动单位丢失的检测指标敏感性更高。
MUNIX可以较好地反映平山病中运动单位丢失所导致的肌力下降,除此以外,本研究还发现远端-近端组患者症状侧的上肢三角肌在没有明显肌力下降的情况下仍然存在MUNIX值明显降低,这提示平山病患者运动单位的丢失早于肌力下降。
早前的研究也证实了类似的观点[35,37],而神经侧枝代偿可能是原因之一。远端-近端组患者症状侧三角肌运动单位大小的异常增大也提示了神经侧枝代偿的可能。根据早先的研究[4,9],肌力通常可以维持在相对强度,直到运动单位丢失速度超过神经侧枝代偿速度。
因此,肌力在没有出现严重运动单位丢失之前并不会显著下降,而MUNIX值的测定在近端累及的平山病患者运动功能评估中具有重要意义。
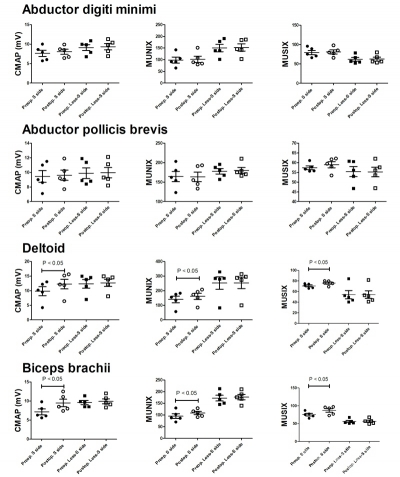
Fig4 所有近端组被检肌的MUNIX值在术前及术后的评估。在术后1年的随访时,MUNIX值,MUSIX值及CMAP波幅均出现了显著增加。S-side:症状侧;Less-S side:症状较轻侧;Preop:术前;Postop:术后;P:P值
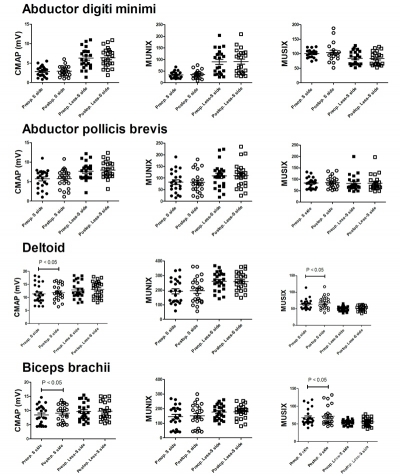
Fig5 所有远端-近端组被检肌的MUNIX值在术前及术后的评估。术后1年随访时,肱二头肌及三角肌的MUSIX和CMAP明显增加,但MUNIX值无明显改变
类似的,远端-近端组所有被检肌的MRC值和DASH评分在术前和术后1年没有显著差异,但近端被检肌的MUNIX值较术前出现了明显改善,而近端组症状侧的肱二头肌也观察到了相同现象。这些发现可能是由于临床功能量表不够理想,无法反应相对细微的改变。临床上,功能改善对平山病患者非常重要;而轻度改善的MUNIX值对评估预后和治疗方式的选择具有重要意义。
相较于上肢远端起病的患者,本研究中近端起病的患者运动功能恢复相对更好。尽管两组患者组术后近端被检肌CMAP波幅均较术前改善,但仅在近端组中我们发现了MUNIX值的增加,提示部分运动神经元功能的恢复或再生。
两组患者组间的不同病理生理机制可能是原因之一。近端组的病理机制可能是由于腹侧神经根或运动神经元的功能异常,而不是运动神经元的丢失,而后者可能是远端-近端组患者的起病原因。但是近端组患者术前病程较短可能是造成不同预后的原因。然而这些结果也表明,与单纯的CMAP波幅相比,MUNIX技术能提供更多信息来支持上述结论。
当前研究的结果应该谨慎解释。由于并不是所有近端型患者均具有满意的手术预后,因此不可能对所有患者采用颈椎前路融合内固定术进行治疗。因此,对于不同的平山病患者群体,可能需要更进一步研究来建立适合的手术指征和手术方法。本研究的另一个局限性是样本量低,特别是近端组患者。
然而,近端组患者运动功能明显改善,这对患者和临床医生都有重要意义。因此,这一初步发现已在本研究中提及,但后期病例数增加可能会获得更有意义的结果。
而MUNIX检测容易受到检查者和检查方法的影响,因此本研究中选择同一检查者,而使用的检查方法也在之前的研究中被证实重复可行[22,37]。
重要的是,Bostock等最近的研究认为MUNIX的可重复性可能是由于CMAP振幅的可重复性较好,而MUNIX几乎完全依赖CMAP振幅,对SIP振幅的变化不敏感[3],而这和SIP存在“运动单位电位叠加”有关[3]。
但是Nandedkar等提出了不同的意见,他们认为如果MUNIX依赖于CMAP,那么两者的比值,如MUSIX,应当是恒定的[23]。而之前的研究ALS的相关研究中已经证实,即使CMAP波幅正常,MUSIX已经出现了明显的增大[9,22],而在本研究的部分平山病患者中也观察到了类似现象。
但是不可否认的是,在一些肌力正常或运动单位较小的健康人群,过度收缩会导致运动单位电位的叠加,进而影响MUNIX的可靠性[3]。因此,Nandedkar等人强调,较轻程度收缩时记录约1/3 SIP信号时,运动单位电位叠加影响最小,这是MUNIX技术的关键组成部分[23]。
在本研究中,我们测定了平山病患者的MUNIX值,而增大的运动单位大小可能减小了叠加效应。根据图3,约2/5 SIP信号在相对较轻的主动收缩时被记录也证实了这一点。但是,未来需要就MUNIX和其他MUNE技术进行进一步比较[17]。
总之,MUNIX技术可以提供一种耗时少,无创的定量方法来评估运动单位的丢失和功能障碍,对近端型和远端型平山病患者的治疗预后研究具有重要意义。在临床上,将MUNIX检测与常规临床和电生理评估相结合,可以为平山病患者的临床研究提供更有价值的依据。MUNIX的测定结果证实颈椎前路融合手术对于近端受累的平山病患者具有一定的疗效,且对近端起病的患者疗效更佳。
参考文献:
1. Ayas ZÖ, Asil K. Atypical type of Hirayama disease: Onset of proximal upper extremity. Ideggyogy Sz 2018; 71:284-7.
2. Bas J, Delmont E, Fatehi F, Salort-Campana E, Verschueren A, Pouget J, et al. Motor unit number index correlates with disability in Charcot-Marie-Tooth disease. Clin Neurophysiol 2018; 129:1390-6.
3. Bostock H, Jacobsen AB, Tankisi H. Motor unit number index and compound muscle action potential amplitude. Clin Neurophysiol 2019; 130:1734-40.
4. Bromberg MB, Brownell AA. Motor unit number estimation in the assessment of performance and function in motor neuron disease. Phys Med Rehabil Clin N Am 2008; 19:509-32.
5. Ciceri EF, Chiapparini L, Erbetta A, Longhi L, Cicardi B, Milani N, et al. Angiographically proven cervical venous engorgement: a possible concurrent cause in the pathophysiology of Hirayama's myelopathy. Neurol Sci 2010; 31:845-8.
6. de Carvalho M, Barkhaus PE, Nandedkar SD, Swash M. Motor unit number estimation (MUNE): Where are we now? Clin Neurophysiol 2018; 129:1507-16.
7. Fatehi F, Grapperon AM, Fathi D, Delmont E, Attarian S. The utility of motor unit number index: A systematic review. Neurophysiol Clin 2018; 48:251-9.
8. Fu Y, Pei X, Zhang J, Kang D, Han H, Fan D. Morphological changes of the lower cervical spinal cord under neutral and fully flexed position by MRI in Chinese patients with Hirayama’s disease. Amyotroph Lateral Scler 2008; 9:156-62.
9. Fukada K, Matsui T, Furuta M, Hirozawa D, Matsui M, Kajiyama Y, et al. The Motor Unit Number Index of Subclinical Abnormality in Amyotrophic Lateral Sclerosis. J Clin Neurophysiol 2016; 33:564-8.
10. Ghosh PS, Moodley M, Friedman NR, Rothner AD, Ghosh D. Hirayama disease in children from North America. J Child Neurol 2011: 26;1542-7.
11. Hassan KM, Sahni H, Jha A. Clinical and radiological profile of Hirayama disease: a flexion myelopathy due to tight cervical dural canal amenable to collar therapy. Ann Indian Acad Neurol 2012; 15:106-12.
12. Hirayama K, Toyokura Y, Tsubaki T. Juvenile muscular atrophy of unilateral upper extremity: a new clinical entity [in Japanese]. Psychiatr Neurol Jpn 1959; 61:2190-7.
13. Hirayama K, Tomonaga M, Kitano K, Yamada T, Kojima S, Arai K. Focal cervical poliopathy causing juvenile muscular atrophy of distal upper extremity: a pathological study. J Neurol Neurosurg Psychiatry 1987; 50:285-90.
14. Hou C, Han H, Yang X, Xu X, Gao H, Fan D, et al. How does the neck flexion affect the cervical MRI features of Hirayama disease? Neurol Sci 2012; 33:1101-5.
15. Huang YC, Ro LS, Chang HS, Chen CM, Wu YR, Lee JD, et al. A clinical study of Hirayama disease in Taiwan. Muscle nerve 2008; 37:576-82.
16. Imai T, Shizukawa H, Nakanishi K, Kouge N, Hiura K, Kashiwagi M, et al. Hyperexcitability of cervical motor neurons during neck flexion in patients with Hirayama disease. Electromyogr Clin Neurophysiol 2000; 40:11-5.
17. Jacobsen A, Bostock H, Fuglsang-Frederiksen A, Duez L, Beniczky S, Moller AT, et al. Reproducibility, and sensitivity to motor unit loss in amyotrophic lateral sclerosis, of a novel MUNE method: MScanFit MUNE. Clin Neurophysiol 2017; 128:1380-8.
18. Jacobsen A, Kristensen R, Witt A, Kristensen A, Duez L, Beniczky S, et al. The utility of motor unit number estimation methods versus quantitative motor unit potential analysis in diagnosis of ALS. Clin Neurophysiol 2018; 129:646-53.
19. Kim J, Kim Y, Kim S, Oh K. Hirayama Disease with Proximal Involvement. J Korean Med Sci 2016; 31:1664-7.
20. Li Y, Remmel K. A case of monomelic amyotrophy of the upper limb: MRI findings and the implication on its pathogenesis. J Clin Neuromuscul Dis 2012; 13:234-9.
21. Lyu F, Zheng C, Wang H, Nie C, Ma X, Xia X, et al. Establishment of a clinician-led guideline on the diagnosis and treatment of Hirayama disease using a modified Delphi technique. Clin Neurophysiol 2020; 131:1311-9.
22. Nandedkar SD, Barkhaus PE, Stålberg EV. Motor unit number index (MUNIX): principle, method, and findings in healthy subjects and in patients with motor neuron disease. Muscle Nerve 2010; 42:798-807.
23. Nandedkar SD, Barkhaus PE, Stålberg EV. Motor unit number index (MUNIX) and compound muscle action potential amplitude: A reappraisal. Clin Neurophysiol 2019; 130:2010-1.
24. Paramanathan S, Tankisi H, Andersen H, Fuglsang-Frederiksen A. Axonal loss in patients with inflammatory demyelinating polyneuropathy as determined by motor unit number estimation and MUNIX. Clin Neurophysiol 2016; 127:898-904.
25. Polo A, Currò Dossi M, Fiaschi A, Zanette GP, Rizzuto N. Peripheral and segmental spinal abnormalities of median and ulnar somatosensory evoked potentials in Hirayama's disease. J Neurol Neurosurg Psychiatry 2003; 74:627-32.
26. Preethish-Kumar V, Polavarapu K, Singh RJ, Vengalil S, Prasad C, Verma A, et al. Proximal and proximo-distal bimelic amyotrophy: Evidence of cervical flexion induced myelopathy. Amyotroph Lateral Scler Frontotemporal Degener 2016; 17:499-507.
27. Preston DC, Ellen B. Electromyography and neuromuscular disorders. Elsevier Butterworth-Heinemann: Philadelphia; 2002.
28. Shao M, Yin J, Lu F, Zheng C, Wang H, Jiang J. The Quantitative Assessment of Imaging Features for the Study of Hirayama Disease Progression. Biomed Res Int 2015; 2015:803148.
29. Toma S, Shiozawa Z. Amyotrophic cervical myelopathy in adolescence. J Neurol Neurosurg Psychiatry 1995; 58:56-64.
30. Tsuzuki N, Zhogshi L, Abe R, Saiki K. Paralysis of the arm after posterior decompression of the cervical spinal cord. I. Anatomical investigation of the mechanism of paralysis. Eur Spine J 1993; 2:191-6.
31. Yang G, Yang X, Zhang M, Yang Y, Xiao B, Li G, et al. Hirayama Disease in Children from Mainland of China. J Child Neurol 2014; 29:509-13.
32. Yokote A, Fukuhara K, Tsugawa J, Tsuboi Y. Juvenile Muscular Atrophy of the Proximal Upper Extremity as So-Called Proximal-Type Hirayama Disease: Case Report and Review of the Literature. Case Rep Neurol 2019; 11:106-11.
33. Zheng C, Zhu Y, Yang S, Lu F, Jin X, Weber R, et al. A study of dynamic F-waves in juvenile spinal muscular atrophy of the distal upper extremity (Hirayama disease). J Neurol Sci 2016; 367:298-304.
34. Zheng C, Zhu D, Lu F, Zhu Y, Ma X, Xia X, et al. A double determination of central motor conduction time in the assessment of Hirayama disease. Clin Neurophysiol 2017; 128:2369-74.
35. Zheng C, Zhu Y, Zhu D, Lu F, Xia X, Jiang J, et al. Motor unit number estimation in the quantitative assessment of severity and progression of motor unit loss in Hirayama disease. Clin Neurophysiol 2017; 128:1008-14.
36. Zheng C, Nie C, Lei W, Zhu Y, Zhu D, Wang H, et al. CAN anterior cervical fusion procedures prevent the progression of the natural course of Hirayama disease? An ambispective cohort analysis. Clin Neurophysiol 2018; 129:2341-9.
37. Zheng C, Song J, Zhu Y, Li X, Zhu D, Lyu F, et al. Motor unit number index (MUNIX) in the quantitative assessment of severity and surgical outcome in cervical spondylotic amyotrophy. Clin Neurophysiol 2019; 130:1465-73.
38. Zheng C, Zhu Y, Shao M, Zhu D, Hu H, Qiao K, et al. Split-hand phenomenon quantified by the motor unit number index for distinguishing cervical spondylotic amyotrophy from amyotrophic lateral sclerosis. Neurophysiol Clin 2019; 49:391-404.
39. Zheng C, Chen Z, Zhu Y, Lyu F, Ma X, Weber R, et al. Motor unit number index in quantitatively assessing motor root lesions and monitoring treatment outcomes in patients with lumbosacral radiculopathy. Muscle Nerve 2020; 61:759-66.
相关阅读:
华山骨科“平山病”系列研究之——颠覆传统观念的“严重”神经系统疾病
不会“自限”的平山病(一)——平山病病情进展的影像学定量评估





 京公网安备11010502051256号
京公网安备11010502051256号