青少年上肢远端不对称性肌萎缩症伴颈椎后凸畸形的手术疗效探究
2021-03-10 文章来源:海军军医大学附属长征医院 郭翔 Ming Lu 谢宁 郭群峰 倪斌 我要说
摘要
研究设计:回顾性临床研究,并进行相关文献回顾。
目的:本研究旨在评估多节段颈椎前路椎间盘切除术及融合内固定术治疗伴有颈椎后凸畸形的青少年上肢远端不对称性肌萎缩症的疗效。
背景资料:青少年上肢远端不对称性肌萎缩症是一种罕见的疾病。传统的治疗方法是使用颈托固定颈部活动。但是,如果该疾病伴有颈椎后凸畸形,则很难采取保守治疗来纠正颈椎后凸畸形,并且预后会恶化。因此,对于伴有颈椎后凸畸形的青少年上肢远端不对称性肌萎缩症,早期进行手术治疗很重要。
方法:从2008年3月至2010年5月,4例患者因缓慢进展的远端无力以及手和前臂肌萎缩的病史而被收治于我院脊柱医学中心。根据临床表现和影像学,这4例患者被诊断为平山病合并颈椎后凸畸形。保守治疗失败后,这些患者接受了多节段颈椎前路椎间盘切除术及融合内固定术。对临床结果进行回顾性评估,随访时间为1.5至3年。
结果:临床和影像学随访表明,所有患者的临床症状、颈椎矢状位和颈椎管容积均得到满意的临床缓解。手术后6个月内,JOA评分从术前平均14分提高到术后平均16.3分。所有患者的JOA恢复率均较为满意。手内在肌、腕部屈肌和伸肌以及二头肌和肱三头肌的肌肉力量平均提高1级。术后无明显并发症。
结论:平山病是一种罕见的疾病,可以根据临床症状和影像学(动态MRI)对其进行诊断。这项研究的主要结果表明,对于表现为颈椎前凸消失和明显后凸畸形的患者,多节段颈椎前路椎间盘切除术及融合内固定术是一种首选治疗方法。
关键词:平山病,屈曲性颈椎病,颈椎后凸畸形,颈前路椎间盘切除术及融合内固定术
青少年上肢远端不对称性肌萎缩症,又称平山病,常见于亚洲国家,尤其是日本[1,2]。其主要见于亚洲青年男性,少见家族聚集发病。该病起病隐匿,以单侧上肢肌萎缩及无力为主要临床表现,通常不累及肱桡肌。大多数患者在暴露于寒冷环境时手指无力症状恶化。少数患者手部局部出现轻度感觉减退[2,3]。该病进展缓慢,大多数患者症状在2年内自发停止[2]。
临床上,平山病是根据远端上肢的典型症状和动态颈椎MRI的结果诊断的,通常表现为硬膜囊前移和颈脊髓受压变扁。尽管该病的病因尚不明确,但一些作者[4,5]认为该病被归类为屈曲性颈椎病(cervical flexion myelopathy, CFM),其特征是屈颈引起的脊髓损伤[6,7]。
CFM的一些病理因素包括由脊髓前方结构引起的脊髓压迫(包括椎体后缘和椎间盘等)[8]、脊髓在轴向方向上的拉伸以及前移的硬膜囊对脊髓的压迫[6]。后者可能是导致单侧上肢肌肉萎缩的主要因素[6,9]。
青少年上肢远端不对称性肌萎缩症是一种非常罕见的疾病。它的发作通常是隐匿的,导致延迟诊断或误诊为周围神经病。
从2008年3月到2010年5月,有4例因单侧上肢远端肌肉萎缩并伴有颈椎后凸畸形的患者被收治于我院脊柱医学中心。他们被诊断为平山病,并在其他医院接受了保守治疗,包括6个月或以上的颈托固定和物理疗法,无明显症状改善。
此外,由于颈椎后凸畸形可加重CFM并对预后产生不良影响,因此,本团队进行了多节段颈椎前路椎间盘切除术及融合内固定术以重建颈椎矢状位并减轻脊髓压迫。在这项研究中,我们回顾了该疾病的诊断流程,并评估了手术的有效性。
病历资料与方法:
从2008年3月到2010年5月,4例患者因缓慢进展的远端无力以及手和前臂肌萎缩的病史而被收治于我院脊柱医学中心,这些患者均已接受超过6个月的颈托治疗,并且无明显症状改善。患者年龄从17岁到24岁不等(平均20.5岁)。
患者症状起初为手指无力,继而无力症状累及其他手指及上肢远端,温度低时症状恶化。无力或肌萎缩症状局限于手内在肌、腕屈肌和伸肌、二头肌和三头肌。症状出现至接受手术的平均时间为2.1年(范围为1-3年)。纳入患者均无神经肌肉疾病家族史。表1列出了所有患者的详细信息,包括基本信息、症状和病程。
根据临床表现、肌电图、中立位及屈颈位颈椎MRI,我们明确了诊断,并对4例患者在全麻下实施了多节段颈椎间盘切除及融合内固定手术[10,11]。患者的随访时间为1.5至3年。在随访时进行X线及MRI检查以评估临床结果,并使用日本骨科协会(JOA)评分系统评估手术前后颈椎病的严重程度。
JOA评分标准:恢复率=((术后JOA评分)-(术前JOA评分))/(17-(术前JOA评分))*100%。恢复情况的评估如下:恢复率≥75%:极好,50%–74%:良好,25%–49%:可以接受;<25%:不佳。我院伦理委员会批准了本研究,所有患者均签署了知情同意书。
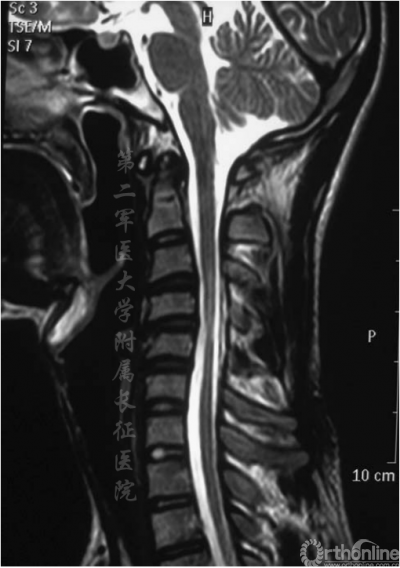
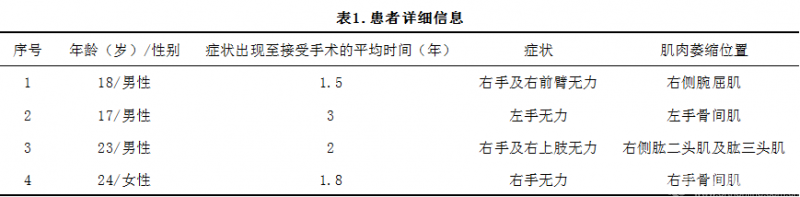
图1.术前侧位MRI显示脊柱后凸,支点在C4-C5水平,颈脊髓明显萎缩
结果:
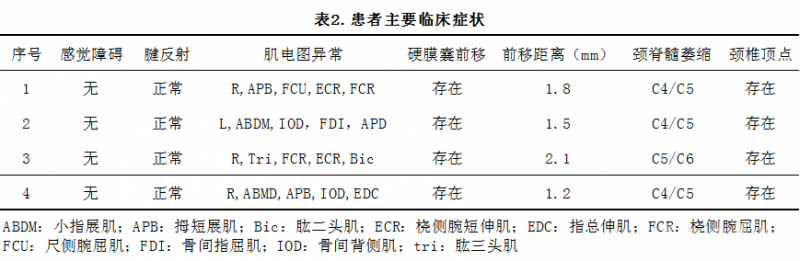
表2列出了查体、电生理和影像学结果。所有患者均无感觉或括约肌症状。上肢和下肢腱反射正常,腹壁反射和颅神经检查正常,无共济失调或步态异常。此外,肌电图检查示单侧萎缩肌肉(肱三头肌和背骨间背肌)可见运动单位形态变宽、单个运动单位波幅增大及干扰相减少,表明脊髓前角神经元受到损害。对侧前臂肌肉正常,且检查发现患者运动和感觉传导速度正常。
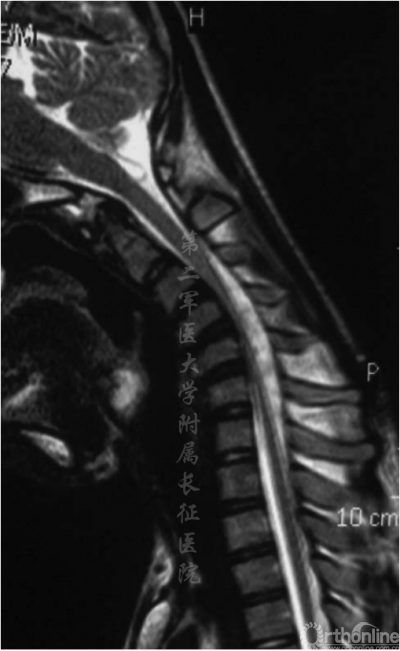
图2.术前屈曲位MRI显示颈硬膜囊向前移位和颈脊髓受压变平
颈椎中立位MRI可见颈椎后凸在C4-C5或C5-C6处具有顶点(图1),且脊髓出现轻度萎缩。屈颈位MRI可见硬膜外高信号影及硬膜囊后壁前移(图2)。头颅MRI未显示异常。根据MRI将患者诊断为平山病伴颈椎后凸畸形。入院三天后,患者在全麻下接受颈前路椎间盘切除术并在C3-C7水平融合以重建颈椎序列和脊柱前凸(图3)。
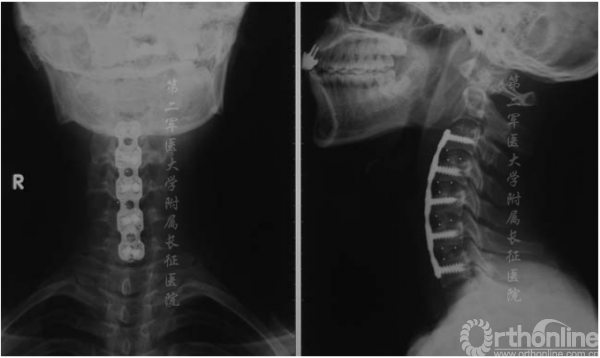
图3.术后x线片显示颈椎前路椎间盘切除术及融合内固定术
表3列出了有关手术方式、术后情况和随访结果的详细信息。手术时间为2.2到3.4小时(平均2.8小时),失血量为200至460mL(平均300mL);术后第二天在床上开始进行肢体功能锻炼。术后2-3天拔除引流管,并进行X线摄片。术后第五天,患者在无支具辅助下进行下肢锻炼,术后7-10天出院。术后三个月佩戴颈托固定。
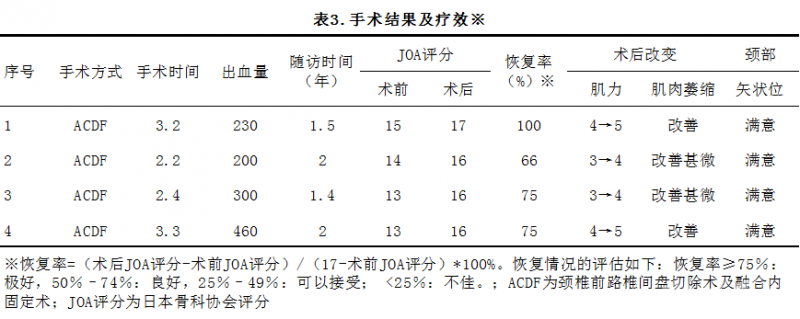
手术后6个月内,JOA评分从术前平均14分提高到术后平均16.3分。所有患者的JOA恢复率均较为满意。内在肌肉、腕部屈肌和伸肌以及二头肌和三头肌的肌力平均提高了1级。骨移植完全融合(图4),颈椎管容积和颈矢状位满意(图5)。没有发生与手术有关的并发症。
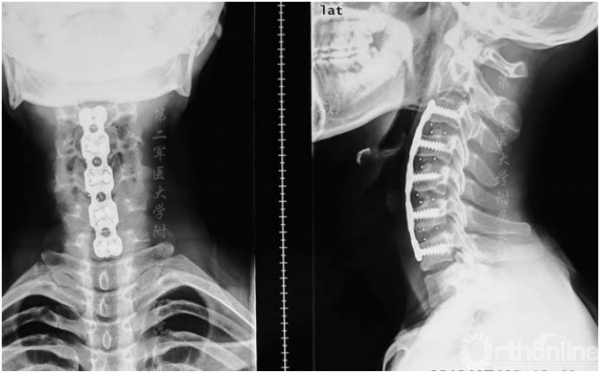
图4.术后6个月x线片显示内固定位置满意,椎体对位齐和骨融合

图5.术后6个月MRI屈颈位图像显示椎管体积和脊髓形态满意
讨论:
尽管平山病的发病机制存在争议,但多数学者认为其病因是由于青春期频繁的屈颈动作引起的一种缺血性颈椎病[2,3]。脊柱和脊髓生长速度不匹配也可能是病因之一。由于生长速度不匹配以及硬膜囊和后方椎板的分离,后根变得相对较短[2]。
在正常情况下,硬脑膜囊通过神经根和硬脑膜鞘固定在椎管内,这些神经根和硬脑膜鞘起着锚的作用,附着在大孔的椎体、C2–C3椎体和尾骨上[12]。此外,硬膜外脂肪、静脉丛和结缔组织可以使剩余的硬脑膜囊松弛并悬浮于椎管内。因此,当颈部屈曲时,椎管长度增加,导致松弛的硬膜囊伸展,但仍可与椎管邻接。
相反,在平山病中,由于椎管和硬膜的生长不匹配,硬膜囊的长度较短,在颈椎中立位已经较紧。因此,颈部屈曲引起颈椎硬膜囊从其后方锚定位置向前移位。硬脑膜向前移位,导致脊髓紧贴椎体后缘,并使颈脊髓受压变扁,从而引起脊髓前角缺血性改变[13]。
根据上述理论,神经功能损害可能是由于颈椎后凸畸形引起的中央管和/或神经孔狭窄所致。脊髓可以在后凸畸形的支点处“贴”在椎体后缘。脊髓被迫到达椎管前部,并随着颈椎后凸的进展而被齿状韧带拉紧。脊髓机械应力的增加可能导致微血管受压和局部缺血。脊髓的慢性血液动力学异常可能导致脊髓型颈椎病和脊髓萎缩。这一理论已经在尸体解剖中得到了证明。
既往研究表明C5到C8/T1节段,脊髓前角的缺血性变化和灰质破坏导致运动神经元数量减少和前根变细[3]。在这项研究中,MRI显示颈椎后凸畸形,其支点位于C4–C5或C5–C6水平,并且伴有T2相高信号及明显萎缩。此外,屈颈位的MRI显示了颈硬膜囊向前移位和颈脊髓受压变扁。患者同时存在单侧前臂肌萎缩和无力。
因此,该病例的临床特征支持以下观点:平山病是具有缺血性发病机理的脊髓病。另外,对于被诊断为平山病的患者,脊髓前角的缺血性改变通常不对称。这可以解释为什么患者症状会呈单侧性。
平山病通常被认为是一种自限性疾病,症状出现后2–3年可稳定。已有研究报道了CFM的保守治疗方法,并证实避免颈屈可防止平山病的进展[14]。最被广泛认可的治疗方法是使用颈托固定1-2年[14-16]。大多数学者认为平山病早期有必要应用颈托,并且在某些情况下应进行手术干预[2,5,17]。
限制颈部屈曲以防止进一步反复伤害脊髓,例如佩戴颈托,通常可以防止颈椎屈曲并阻止疾病进展[18]。其他研究发现手术治疗对平山病患者有益[5,17,19],手术表现出更好的预后和令人满意的神经功能改善。当佩戴颈托治疗无效时,颈椎减压手术也可获得令人满意的疗效。此外,随着脊柱后凸的进展,脊髓进一步被压扁,甚至引起组织病理学改变,包括脱髓鞘和神经元丢失[20,21]。
如上所述,本文报道的患者患有平山病并伴有明显的颈椎后凸畸形,颈托治疗无效。因此,必须采取针对潜在病理生理机制的手术干预措施,以防止病情进一步发展。前路和后路手术究竟哪一种更适合此类患者,目前仍存在争议[5]。有学者提出,前路或后路手术在疗效方面无显着临床差异。但是,对于颈椎后凸角度较大、引起明显脊髓压迫的患者,前路减压融合可以有效矫正畸形和颈椎排列,从而预防疾病的发展。
有趣的是,在这项研究中,患者大多表现出下运动神经元症状。在我们的病例中,MRI显示C4–C5或C5-C6水平的脊髓高信号,对应脊柱的最大后凸弯曲。这些病理变化与平山惠造在其病例系列中观察到的变化相似[2]。
在脊髓微循环障碍中,前角细胞对局部缺血高度敏感,但皮质脊髓束(corticospinal tracts, CST)并未受到影响,因为它们位于边界区。CST在青春期会经历成熟过程,并且在大多数青少年中,只有在13岁以后才具有电生理功能[22,23]。青春期CST的相对不成熟可以解释为什么平山病(或压迫性脊髓病)的年轻患者未表现出明显的CST缺陷[24]。
结论:
表现为单侧或双侧不对称的手部和/或前臂尺侧肌肉萎缩且无感觉障碍的年轻患者应考虑平山病。屈颈位MRI对于明确诊断是必要的。保守治疗对于病程较短的患者可能是有效的。但是,本次临床研究的主要结果表明,对于合并明显颈椎后凸畸形的患者,多节段颈椎间盘切除及融合内固定手术是一种首选治疗方法。
由于平山病的罕见性,本研究样本量较少,且为单中心回顾性研究,因此无法满足前瞻性研究的严格要求。因此,目前的结论可能会存在偏移。多中心前瞻性队列研究可能有助于进一步验证多节段颈椎间盘切除及融合内固定手术治疗平山病合并颈椎后凸畸形的有效性。
作者简介:

倪斌
海军军医大学长征医院骨科主任医师、教授,博士生导师,骨科医院副院长。
任国际脊柱内固定协会(AO脊柱)中国理事,上海医学会骨科专业委员会脊柱外科学组组长,中华医学会老年医学分会骨关节委员会常委,全国中西医协会脊柱专业委员会常委,中华医学会老年医学分会脊柱外科委员,中国医疗促进会骨科委员会委员、中国康复学会脊柱脊髓专业委员会脊柱学组委员等任职。任中国矫形外科杂志(颈椎外科)主编,中国脊柱脊髓杂志、脊柱外科杂志等6部杂志常务编委、编委。国家自然科学基金评专家,军队和上海市科委科技项目、国家科技进步奖评审专家。
承担国家、军队、上海市等一系列重大科研项目,获国家科学技术进步二等奖1项,上海市科学技术进步一等奖1项,上海市临床医疗成果一等奖1项,军队科学技术进步二、三等奖3项。先后荣获三等功二次,获总后育才奖银奖、长征医院优秀科技工作者(金奖)称号。在国内外杂志共发表学术论文300余篇。以第一作者及通讯作者发表SCI论文70余篇。主编(副主编)专著8部,参编专著及教材共27部。

郭翔
临床医学博士,副主任医师、副教授,硕士生导师,海军军医大学附属长征医院脊柱4科主任助理。
兼任上海市中西医结合学会骨伤科专业委员会青年副主任委员,上海市社会医疗机构协会骨科分会脊柱专业委员会常务委员,上海市医学会骨科学分会浦菁会脊柱学组成员。
承担国家自然科学基金3项(2012、2016、2018),上海市卫生局面上基金(2014)、军队后勤重点科研项目子课题(2019)、院转化医学课题(2014) 各1项;以第一作者或通讯作者(含共同)发表SCI论文11篇,大于10分的1篇,大于5分的1篇,总IF 42.812(2019);以第一完成人获得军队医疗成果三等奖1项(2014),以主要完成人获得上海科学技术进步一等奖1项(2007);以申请人授权国家专利7项;主编英文专著1部。
擅长颈椎病、颈椎管狭窄症及颈椎韧带骨化症,胸椎管狭窄及韧带骨化症,腰椎间盘突出及腰椎狭窄症的外科治疗。对于先天性、特发性脊柱侧弯的综合治疗也具有相当的经验,特别是对于枕颈部先天性畸形的外科手术治疗具有一定造诣。

郭群峰
医学博士,现任海军军医大学附属长征医院脊柱外科副主任医师、副教授,硕士生导师。
兼任上海市中西医结合学会脊柱医学专业委员会委员,上海市中西医结合学会骨伤科专业委员会青年委员,上海市康复医学会骨科康复医学会青年学组委员,中国残疾人康复协会肢体残疾康复专业委员会委员,中国残疾人康复协会肢体残疾康复专业委员会脊柱康复学组委员,上海市住院医师规范化培训带教及结业综合考核考官,AO会员。德国BG Unfallklinik Frankfurt am Main gGmbH脊柱中心访问学者。
主持上海市自然科学基金等项目研究2项,共同承担国家自然科学基金7项、上海市基金3项、学校教改重点课题1项;以第一/通讯作者(包含并列)发表SCI论文29篇,发表核心期刊论文2篇;主编英文专著1部,参编著作5部;获专利8项。共同完成中国人民解放军医疗成果奖二等奖(2015年)、三等奖(2014年)各1项。
参考文献:
1. Gandhi D, Goyal M, Bourque PR, et al. Case 68: Hirayama disease.
2. Hirayama K. Juvenile muscular atrophy of distal upper extremity (Hirayama disease). Intern Med. 2000;39:283–290.
3. Hirayama K. Juvenile muscular atrophy of distal upper extremity (Hirayama disease): focal cervical ischemic poliomyelopathy. Neuropathology. 2000;20(suppl):S91–S94.
4. Kira J, Ochi H. Juvenile muscular atrophy of the distal upper limb (Hirayama disease) associated with atopy. J Neurol Neurosurg Psychiatry. 2001;70:798–801.
5. Kohno M, Takahashi H, Ide K, et al. Surgical treatment for patients with cervical flexion myelopathy. J Neurosurg. 1999;91:33–42.
6. Kikuchi S, Tashiro K, Kitagawa M, et al. A mechanism of juvenile muscular atrophy localized in the hand and forearm (Hirayama’s disease)—flexion myelopathy with tight dural canal in flexion. Rinsho Shinkeigaku. 1987;27:412–419.
7. Iwasaki Y, Tashiro K, Kikuchi S, et al. Cervical flexion myelopathy:
a “tight dural canal mechanism”. Case report. J Neurosurg. 1987;66:935–937.
8. Watanabe K, Hasegawa K, Hirano T, et al. Anterior spinal decompression and fusion for cervical flexion myelopathy in young patients. J Neurosurg Spine. 2005;3:86–91.
9. Schroder R, Keller E, Flacke S, et al. MRI findings in Hirayama’s disease: flexion-induced cervical myelopathy or intrinsic motor neuron disease? J Neurol. 1999;246:1069–1074.
10. Chang SW, Kakarla UK, Maughan PH, et al. Four-level anterior cervical discectomy and fusion with plate fixation: radiographic and clinical results. Neurosurgery. 2010;66:639–646. discussion 646–647.
11. Dai LY, Jiang LS. Anterior cervical fusion with interbody cage containing beta-tricalcium phosphate augmented with plate fixation: a prospective randomized study with 2-year follow-up. Eur Spine J. 2008;17:698–705.
12. Shimizu K, Nakamura M, Nishikawa Y, et al. Spinal kyphosis causes demyelination and neuronal loss in the spinal cord: a new model of kyphotic deformity using juvenile Japanese small game fowls. Spine. 2005;30:2388–2392.
13. Hirayama K, Tokumaru Y. Cervical dural sac and spinal cord in juvenile muscular atrophy of distal upper extremity. Neurology. 2000;54:1922–1926.
14. Masaki T, Hashida H, Sakuta M, et al. A case of flexion myelopathy presenting juvenile segmental muscular atrophy of upper extremities—a successful treatment by cervical spine immobilization. Rinsho Shinkeigaku. 1990;30:625–629.
15. Tokumaru Y, Hirayama K. Cervical collar therapy for juvenile muscular atrophy of distal upper extremity (Hirayama disease): results from 38 cases. Rinsho Shinkeigaku. 2001;41:173–178.
16. Chen CJ, Chen CM, Wu CL, et al. Hirayama disease: MR diagnosis.
AJNR Am J Neuroradiol. 1998;19:365–368.
17. Imamura H, Matsumoto S, Hayase M, et al. A case of Hirayama’s disease successfully treated by anterior cervical decompression and fusion. No To Shinkei. 2001;53:1033–1038.
18. Cerami C, Valentino F, Piccoli F, et al. A cervical myelopathy with a Hirayama disease-like phenotype. Neurol Sci. 2008;29: 451–454.
19. Lin MS, Kung WM, Chiu WT, et al. Hirayama disease. J Neurosurg Spine. 2010;12:629–634.
Radiology. 2004;230:692–696.
20. Hashimoto M, Yoshioka M, Sakimoto Y, et al. A 20-year-old female with Hirayama disease complicated with dysplasia of the cervical vertebrae and degeneration of intervertebral discs. BMJ Case Rep. 2012;2012:1–4.
21. Han K, Lu C, Li J, et al. Surgical treatment of cervical kyphosis. Eur Spine J. 2011;20:523–536.
22. Nezu A, Kimura S, Uehara S, et al. Magnetic stimulation of motor cortex in children: maturity of corticospinal pathway and problem of clinical application. Brain Dev. 1997;19:176–180.
23. Paus T, Zijdenbos A, Worsley K, et al. Structural maturation of neural pathways in children and adolescents: in vivo study. Science. 1999;283:1908–1911.
24. Yoshimura K, Kurashige T. Age-related changes in the posterior limb of the internal capsule revealed by magnetic resonance imaging. Brain Dev. 2000;22:118–122.
相关阅读:
华山骨科“平山病”系列研究之一—— 颠覆传统观念的“严重”神经系统疾病
不会“自限”的平山病(一)—— 平山病病情进展的影像学定量评估


 京公网安备11010502051256号
京公网安备11010502051256号