文献翻译:转移性脊柱肿瘤(综述)
2017-12-28 文章来源:翻译:施建党 何进文 点击量:2839 我要说
作者:DavidChoi, PhD∗ MarkBilsky, MD‡ MichaelFehlings, MD, PhD§ CharlesFisher, MD ¶ ZiyaGokaslan, MD||
∗ DepartmentofNeurosurgery,theNational Hospital for Neurology and Neurosurgery, London, UK;
‡ Department of Neurosurgery, Memorial Sloan-Kettering Cancer Center, New York;
§ Division of Neurosurgery and Spinal Program, University of Toronto, Toronto, Canada;
¶ DepartmentofOrthopaedics,Divisionof Spine, University of British Columbia and Vancouver General Hospital, Vancouver, Canada;
|| Department of Neurosurgery, The Warren Alpert Medical School of Brown University, Providence, Rhode Island
脊柱转移癌的手术治疗主要是解决由于肿瘤浸润脊柱而引起的疼痛,不稳和神经功能恶化。然而,一些新的治疗方法可以更好地改善预后,在有些病例中甚至可以取代外科手术。我们现在对术后生存和生活质量的影响因素有更好的了解,从而促进了新疗法和疗效评估方案的研究和应用。
根据肿瘤的遗传亚型,新的免疫疗法和化学疗法可能对延长生存期非常有效。新的手术技术更小、更快、更安全,有效减少出血和疼痛,术后更快康复。从增加强度的光子辐射,立体定向放疗,到质子束治疗或碳离子治疗,放射治疗也可以向更高的准确性和更高的剂量跳跃。结合更先进的椎体稳定材料、计算机导航系统和机器人技术,无论是脊柱疾病的早期还是晚期,都为患者提供更多的治疗选择,改善患者的预后。
缩写:SBRT(立体定向放射治疗)、PMMA(聚甲基丙烯酸甲酯)、PEEK(poly-ether-ether-ketone)、SINS(脊柱肿瘤不稳定性评分)。
手术治疗脊柱转移癌可以改善疼痛,改善神经功能和生活质量1-3。近年来,新技术的进步有效改善了这种疾病的预后。了解影响生存期和生活质量的因素可以帮助医生和病人做出合适的治疗决策2,4–6,针对遗传亚型的治疗、新型免疫疗法、放射技术的进步,病人可以接受个体化治疗并从中受益。外科手术技术的进步,通过微创技术重建椎体的完整性,避免较大的开放性手术,可以帮助患者减轻疼痛,术后快速康复。经皮骨水泥椎体成形、人工椎体置入术、经皮内固定术可以用于预后较差的患者。用于脊柱重建的新材料和器械降低了手术难度,并且新材料可以更好地透过射线,术后可以进行更有效的放射治疗和放射性检查。三维打印技术可以为患者定制生产组件来进行脊柱重建,为患者量身定制脊柱模型,帮助外科医生更有效地计划肿瘤切除和重建方案。计算机导航系统和机器人导引系统可以实现更精确的肿瘤切除、假体植入以及更好地掌握变异和复杂的解剖结构。
个性化治疗
遗传亚型分析
肿瘤遗传学分析已经彻底地革新了转移性肿瘤尤其是乳腺癌、黑色素瘤和某些肺癌的治疗方案7,8。
对于非小细胞肺癌,如果表皮生长因子受体突变的遗传分析阳性,则患者对免疫治疗(厄洛替尼9)和化疗(培美曲塞-顺铂10)敏感,且有效中位生存时间大于2年。如果间变性淋巴瘤激酶-棘皮动物微管相关蛋白样融合蛋白的遗传分析阳性,则可以使用克唑替尼免疫疗法11。
肾细胞癌可以耐放疗和传统化疗,但新型免疫疗法(舒尼替尼和帕唑帕尼)对其控制率可以达到50%以上12。
具有阳性BRAF突变的黑色素瘤的免疫治疗效果也很好,即使在晚期转移癌患者中也能提高生存率13。
预后和风险评估
预后评分可以评估生存期和生活质量,为正确的治疗决策提供指导。为病人个体化定制合适的手术方案非常重要。太多数手术,太晚的手术可能不会使患者受益,相反,过于保守的治疗方案可能会使患者丧失行走能力或难以改善生活质量。预后评分系统可以帮助患者更好地了解脊柱转移癌的风险,评估生存期和生活质量。一般来说,较大的手术可能会改善远期效果,但也可能会导致更严重的手术并发症,丧失手术的意义。因此,选择合适的手术方案,评估患者能否耐受手术风险或经过手术治疗能否延长生存期是很有必要的(尽管不是那么容易)。
使用最多的转脊柱转移癌评分系统是Tomita评分4和Tokuhashi评分5,其包括原发肿瘤类型,是否存在内脏转移,脊柱转移灶的数量,另外Tokuhashi评分还包括神经功能和Karnofsky功能状态。这些评分系统已经被广泛应用2,14,15,虽然也有各自的应用局限,但仍然是有用的工具,可以协助制定手术决策。其他预后评分系统遵循类似的方法,但重点放在不同的变量上16。
在近十年中,基因亚型分析已经可以针对个体更具体地估计某些肿瘤的预后。一些肿瘤的预后更多地由其基因亚型分析决定而不是其他因素。虽然普通的预后评分系统仍然有其用途,但它们难以在临床实践中被广泛接受和采用,一些外科医师也质疑其有效性17,特别是由于基因分型的出现,预后的影响因素更多。例如,如果转移性黑素瘤在原发肿瘤的遗传表型中具有BRAF突变,对免疫疗法的反应直接影响生存期,而不是脊髓和内脏转移灶的数目。对于非小细胞肺癌中的表皮生长因子受体状态以及乳腺癌中的雌激素,黄体酮或HER2受体状态也是如此。因此,更“现代”的方法并不是依靠预后评分系统,而是建立包括转移癌遗传亚型的风险分层、Tomita4或Tokuhashi5评分在内的评估系统,来确定患者就诊时的中位生存期。现代脊柱外科医生应该充分了解原发肿瘤的生物学类型,影响预后的因素,从而做出合理的手术选择。
放射和粒子疗法的进展
传统上,手术治疗一般在放射治疗之前进行。但随着现代放射治疗方案的出现,包括强度调整放疗和立体定向放疗(SBRT)以及重粒子疗法,这种现状已经被改变。如果没有即将出现的脊柱不稳或症状性脊髓压迫,这些技术可以在手术之前甚至代替手术使用。手术,并不是旨在完全切除肿瘤,现在可以达到“分离手术”的目标,以在关键区域如脊髓周围产生足够的空间,来达到足够的放疗剂量,同时减少对脊髓的损伤。早期证据表明了分离手术在局部疾病控制中的疗效18,分离手术要在局部具有足够的放疗剂量,达到良好的治疗效果,虽然很少有这方面的数据支持。
放射治疗已经在过去十年经历了革命性的发展,立体定向放疗19,20和重粒子疗法,如质子束或碳离子治疗的引进。之前耐受常规放疗的肿瘤现在对高剂量的定向疗法敏感。鉴于重粒子治疗脊柱转移瘤疗效的证据很少,其主要效果与SBRT相似,但其剂量较高,并发症少。SBRT已被用于早期治疗,术后治疗和补救性再照射。立体定向放疗的治疗剂量可以用于早期转移,以减缓脊髓压迫和机械不稳,特别是对于放射抗性肿瘤如肾细胞癌、肉瘤和黑素瘤。如果有明显的不稳或脊髓压迫19,可以在手术之前先进行立体定向放疗,虽然SBRT通常用在微创术后进行。除了提供局部病灶控制,SBRT还可以对生命终末期患者的姑息治疗起显著作用,可以使80%至85%患者的疼痛得到控制21。但是,有一点必须牢记,SBRT等局部高剂量放疗技术可以使11%〜39%的患者发生迟发性椎体骨折,因此应该考虑包括预防性椎体成形术在内的策略来预测和缓解这种风险。22
外科技术的进步
在过去的几十年中,已经开发了多种新的外科技术,减少了术后疼痛和住院时间,使脊柱转移癌手术更安全、更易被患者接受。微创技术是脊柱肿瘤外科医生技术范围的有效补充,应该被熟练掌握。然而,“一刀切”并不适合所有问题,外科手术方式的选择有外科医生相关因素,如技术能力和对新技术的熟练程度,患者相关因素,比如手术指征(疼痛控制,稳定性,减压或分离手术)和预后。术前脊柱MRI和CT检查对于掌握手术的解剖部位和手术方法的潜在局限性至关重要。微创技术的应用通常需要较高的学识水平和严格的训练,因为工作通道狭窄,工作距离长,还有出血增加和脑脊液漏的风险。
经皮椎体成形术
侵袭性较小的技术可以使患者恢复更快,并发症发生率更低,为预后较差的患者的姑息性治疗提供了更多的选择。经皮椎体成形术通常用来治疗骨质疏松性压缩性骨折,现已被成功引入于脊柱转移癌病理性骨折的治疗。椎体成形术通过注射粘性聚甲基丙烯酸甲酯(PMMA)骨水泥,为受累椎体提供结构完整性23,24。Xie等人23报道47例脊柱转移患者接受椎体成形术后疼痛视觉模拟评分从8.4分降到3.4分左右。通过在受累椎体内暂时膨胀球囊进行后凸成形,可以在比椎体成形术更低的注射压力下用骨水泥填充空腔,还可以减轻压缩骨折25。新型的替代技术,比如使用可膨胀千斤顶26机械性提高椎板高度以改善病理性压缩骨折,或在可膨胀气囊周围使用钛啮合椎体支架27。以前,放疗是预后不良或无法耐受手术的患者的首选治疗方法。然而,经皮椎体成形术的推广已经扩大了手术干预的适应证,包括对疼痛的姑息控制和不伴脊髓压迫的脊柱不稳。这些技术可以将放射治疗中发生的附带损伤降至最小,并且可以提供快速的手术效果,减少并发症。椎体成形术也可以与经皮或开放的椎弓根螺钉联合使用,并且可以减少固定节段。
然而,如果椎体后壁的皮质被肿瘤破坏溶解,该手术的使用可能受限,因为可能出现骨水泥渗漏,导致潜在的脊髓或神经根损伤。禁忌症包括感染,凝血功能紊乱或过度的椎体塌陷(丧失大于三分之二的椎体高度)。
经皮射频消融术
随着经皮椎体成形术的发展,已经开发出用于消融肿瘤的其他技术,来改善疼痛并降低脊髓压迫的风险。由于电极插入技术类似于经皮椎体成形术,所以射频消融可以与经皮椎体成形同时进行,或单独作为破坏椎体内肿瘤组织的方法28,29。这种方法的远期疗效尚不清楚,但这种技术可能是微创性姑息治疗的有益补充。
射频消融的适应症包括不可切除的溶骨转移、不适合手术的患者、预后不良或常规的放疗或化疗方案不能奏效。禁忌症包括体内植入电子设备,如心脏起搏器。如果肿瘤距离脊髓1厘米以内,应谨慎进行手术,并应使用硬膜外温度监测和盐水冲洗来尽量减少热传导。
微创通道撑开器
微创通道撑开器对于胸腰椎手术更有优势,可以通过较小的皮肤切口直达手术区域。用可扩张的椎体置换假体进行病椎的切除和稳定性重建,对组织损伤最小,有利于行动能力的快速恢复和尽早出院,也可以避免开胸术或前外侧腹部入路手术。将开放手术的技能应用到微创通路撑开器是相对简单和直观的,不同于内窥镜手术技术的高学习成本30。尽管证明这种微创技术有效性的证据有限,而且大多数已发表的文章是无对照研究,报告的患者数量很少,但总体上的共识是,与传统的开放式方法相比,这些方法可以减少出血和疼痛,与引文中的2个综述中所讨论的一致31,32。
借助传统入路对解剖的熟悉,后路微创技术方法更容易掌握,如今已经设计出了可以置入椎弓根螺钉和椎体替换器的微创撑开器系统,通过传统的后路椎弓根钉入路,达到对解剖结构的最小破坏33,34。
胸腔镜手术
内窥镜微创手术治疗胸椎转移癌可以有效减少开胸手术的并发症,并且肋间神经痛、胸腔积液和血肿的风险较低。35,36然而,这些技术的学习成本比微创开放手术更高,并且可能比传统手术的有更多的出血量和手术时间。30胸腔镜手术需要在设备、医生、人员培训方面投入更多的资金,并且需要培训熟悉手术程序的助手。一项关于胸腔镜椎体切除术的研究发现平均手术时间为4.9小时,患者住院时间为8.2天37。
椎弓根螺钉技术的进展
经皮椎弓根螺钉
使用Jamshidi骨针和Kirschner导丝放置的经皮椎弓根螺钉已经彻底改变了后路固定的适应症(图1)。以前,对于预期寿命少于3个月的患者不建议进行手术。然而,临床医生往往难以正确估计患者的预期寿命38,而预期寿命较短的患者可能从减轻腰痛的内固定中受益。经皮椎弓根螺钉可用于预后不良的患者的姑息治疗和疼痛缓解,改变了内固定手术的适应证。经皮椎弓根螺钉常用于治疗腰椎退变性疾病,一些案例证明,与开放式方法相比,其并发症发生率较低,术后椎旁肌肉萎缩较少。39,40

图1经皮椎弓根螺钉系统。A,T11黑色素瘤转移患者的MRI表现,多发性皮损,肝,肺,脑转移,表现为背痛。B,侧位X线片显示经皮椎弓根螺钉姑息性治疗疼痛。C,正位X线片。
碳纤维螺丝
碳纤维增强PEEK(poly-ether-ether-ketone)椎弓根螺钉现在已经有制造商生产,碳纤维比例高(超过60%)(图2)。单向挤压成型的碳纤维螺钉强度独特,与标准钛螺钉相当。短的非金属碳纤维棒用于治疗脊柱转移癌的内固定系统,射线可以更好地穿透(图3)。这些系统有两个主要优点:通过减少MRI或CT成像上的伪影,更容易观察螺钉位置和监测肿瘤复发; 脊柱转移患者术后经常使放射治疗,而碳纤维结构对射线的屏蔽和散射较少,从而允许更高和更准确的放射剂量到达病灶。
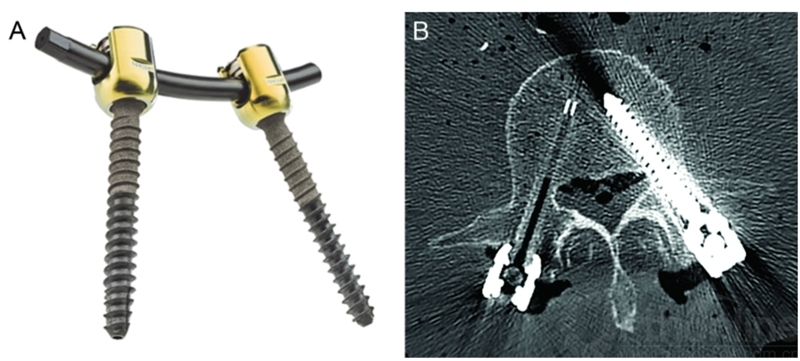
图2碳纤维增强PEEK椎弓根螺钉。A,碳纤维螺丝,钛合金多轴头,碳纤维增强棒。B,CT横断面扫描,(图片右侧)病人体内左侧为钛椎弓根螺钉,右侧为碳纤维螺钉,伪影更少。改良自Icotec TM。
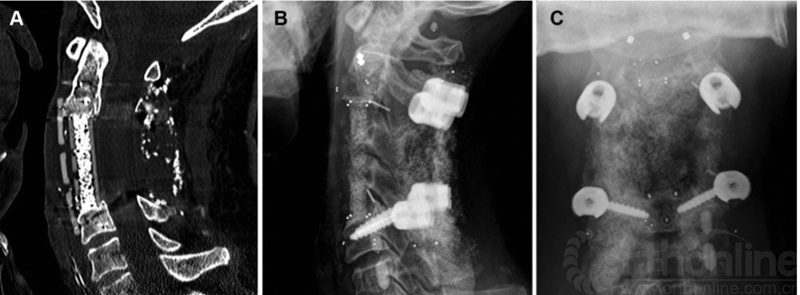
图3C3和C4椎体切除术,后路C2和C5碳纤维椎弓根螺钉固定,前路置入cage和钛板。射线有效穿透可以为后续的放疗提供更准确的剂量计划。A,矢状位CT扫描显示前方碳纤维板和锁定螺钉,融合器和植骨融合。B,侧位片显示植入物的放射透明度。可以看到C2螺钉的钛多轴头和标准钛C5螺钉。所有碳纤维成分在融合器的角落用小型不透射线标志物表示,螺丝尖端、标记钛板的前端和后棒的末端。C,正位X线片。
近几十年来,随着社会老龄化程度加重。原发肿瘤的控制率升高和生存质量的改善,患有转移性疾病和椎体骨质疏松的患者更多。已经开发出的带孔椎弓根螺钉,通过螺钉将PMMA骨水泥注入到椎体内,以降低螺钉拔出和失效的风险41,42。
减少螺钉失效的另一种策略是使用可扩大螺钉。在置入椎弓根螺钉之后,内部机构缩短螺钉并且允许开槽尖端扩张,可以更多地用于骨质疏松椎体43。
在脊柱转移患者中,骨融合常常受到营养不良、伤口愈合、化疗和放疗的限制。一些外科医生考虑到患者有限的预期寿命和异物植入导致感染的风险增加,所以在转移性疾病的情况下不使用骨移植物。人造羟基磷灰石作为骨移植替代品的使用日益普及,并且降低了取髂骨相关的感染、疼痛和骨折的风险,且取髂骨区也可能受到转移性疾病的影响。
多学科团队协作
对于大多数脊柱转移性疾病的患者,脊柱外科医生、肿瘤科医师、放射治疗师、放射科医师、病理学家、护士组成一个多学科团队,最终根据患者的情况进行讨论,以确定最佳的治疗方式。通常,手术可能不是首选的治疗选择,特别是老年患者或预后差的患者,在手术治疗前需要慎重考虑44。脊柱转移癌治疗方面的一个重大进展是人们普遍认识到,集体决策对于确定这一复杂病人群体的最佳治疗方法至关重要,每周举行一次脊柱肿瘤会议来讨论患者的治疗方案现在已经很普遍。此外,基于电子通信技术的“虚拟咨询”系统可以促进多学科讨论和磋商。45
多学科小组通常每周会面一次讨论治疗决策,如果紧急情况下不能等到下次讨论,还需要有组织紧急讨论的机制。团队中的肿瘤学家通常会对病例进行分类,并讨论可能受益于外科手术的病人。预后可以由肿瘤学家和外科医生共同估计,讨论非手术治疗对生活质量和疾病进展的益处。脊柱外科医生将决定可以实施哪些外科手术,平衡手术的相对风险和收益、成功的可能性,以及患者能否耐受手术或外科干预。肿瘤科医生将评估放射治疗的有效性或替代方案的疗效。病理学家和放射学家将对所必需的组织学和放射学数据进行解释,方便做出合理的治疗决策,物理治疗师和护理人员对于患者的康复和身心健康是非常重要的。多学科小组的所有成员都将在患者的治疗中做出伦理和道德方面的贡献,并在决策制定过程中学习和沟通。
脊柱肿瘤不稳定评分(SINS)是由跨学科团队开发的独特工具,它允许专家和非专业人员对脊柱转移造成的不稳定程度进行量化[46]。尽管SINS对预后的价值仍有待评估,但这仍然是一个可靠和有效的工具,能帮助肿瘤科医师、放射科医生和外科医生之间有效沟通,并规范脊柱肿瘤文献中的数据报告47,48。
材料与工程进展
PEEK和碳纤维增强PEEK现在广泛用于椎体置换和椎弓根钉系统。它们具有优异的弹性和与钛棒相似的强度,并且成像伪影小,允许放疗射线穿透49。利用组织工程学技术研发的可膨胀融合器,其体积小,填充自体骨或人工骨后更容易植入。这些钛制品已经得到了广泛的应用,具有出色的可操作性、容易放置、X线下可视性等有点,并且方便肿瘤复发的监测。
在许多医疗机构中,PMMA骨水泥的使用率又在重新升高,在手术中可以定制支撑物的形状和构造,通过压力填充或使用克氏针固定骨水泥块,或将骨水泥填充在钛网或钛笼中50。
使用塑料聚合物或钛结构的3D打印也是一种新技术,通过CT扫描为患者定制个性化的支撑结构形状。该技术对于复杂解剖结构区域(包括上颈椎和颅颈交界处)是特别有价值的51。聚合物或钛粉在二维层面中连续打印,利用计算机技术生成定制的三维结构植入体。
无框架立体定向脊柱导航系统和机器人辅助引导允许精确的肿瘤切除和置入椎弓根螺钉,与传统的椎弓根螺钉技术相比,具有更高的准确性和更少的透视量52,53。
结论
手术在具有症状的脊柱转移患者的治疗中起关键作用。在适当的情况下进行高质量的手术可以显着改善生活质量和生存期。然而,偶尔发生的手术并发症会对患者带来不利影响,特别是那些预后差和预期寿命有限的患者。虽然癌症的医学治疗的进步可能会减少未来手术的需求,但也可能有相反的效果:增加高龄患者和脊柱广泛转移患者的数量。微创导航通路手术,并发症少,术后疼痛少,可能在未来发挥重要作用,并与免疫疗法和放疗技术的进步并驾齐驱。脊柱转移癌的多学科联合治疗需要多个内科和外科医生之间的密切沟通,并与患者进行公开讨论,以制定不同情况下最合适的治疗方案。
脊柱转移癌的治疗述评
脊柱转移癌的治疗目标是缓解疼痛、保证脊柱稳定、帮助患者重获行走功能、改善生活质量等。由于原发肿瘤的治疗是脊柱转移癌的治疗的基础,过去认为癌症骨转移时患者病情已处于癌症的晚期,因此对于骨转移癌的治疗偏向姑息。然而随着治疗理念、放射治疗技术、手术技术及内固定材料发展水平的提高,目前对脊柱转移癌的治疗方式发生了根本性的变化。本篇文章对骨转移的治疗新进展进行了详细的阐述。
过去放疗是主要的治疗方法。传统放疗对于放疗技术的选择基于原发肿瘤对放疗的敏感性,因此对于放疗不敏感的肿瘤治疗效果十分有限。随着现代放疗技术的进展,新的放疗技术的临床应用逐渐成熟,根据转移病灶的特点采用立体定向放射治疗(SRS)等全新的技术,颠覆了传统放射治疗的观念,对原本对放疗不敏感的肿瘤,也取得了良好的疗效。
以往由于手术技术和内固定材料发展所限,脊柱转移癌的手术方式非常少。针对脊柱转移癌的手术多采用后路单纯椎板切除术等,手术效果并不理想。全脊椎整块切除术为脊柱原发性肿瘤的治疗带来了革命性突破,但对于脊柱转移癌患者来说,此手术给患者也带来巨大的创伤。患者常未享受到手术所带来的福利就已频临死亡,投入与受益极不平衡。目前手术治疗方法逐渐向微创技术过渡,微创方法包括了经皮穿刺椎体成形术、经皮穿刺椎体后凸成形术、内窥镜辅助手术和射频消融术等技术。另外,新的观念如“分离手术”,在脊髓与肿瘤组织之间建立2~3mm的间隙,以满足放疗梯度区,减少了对放疗中损伤脊髓组织的顾虑。对控制局部肿瘤进展效果显著。
多学科合作综合治疗被认为是现代脊柱转移癌的主要治疗模式,各学科的集体决策对于治疗方案的选择至关重要,包括对疾病的系统评估、病人的状况评估、手术治疗方式、放化疗或药物靶向治疗、镇痛与康复治疗等。在决定行外科治疗时需要考虑肿瘤类型、分级、患者的一般状态、可能的预后与生存期等。目前指导脊柱转移癌患者的临决策有Harrington分级、Tokuhashi评分和Tomita评分、脊柱稳定性的评分系统(SINS)等。
总之,随着多学科团队协作、预后评估系统的完善、放疗技术的改进,内固定器械的研制、微创手术技术的进步、目前对脊柱转移癌的治疗方式有了更为理性的选择,脊柱转移癌的治疗效果也得到了明显的提升。
参考文献
1. Patchell RA, Tibbs PA, Regine WF, et al. Direct decompressive surgical resection in the treatment of spinal cord compression caused by metastatic cancer: a randomised trial. Lancet. 2005; 366(9486): 643-648.
2. Choi D, Fox Z, Albert T, et al. Prediction of quality of life and survival after surgeryforsymptomaticspinalmetastases:amulticentercohortstudytodetermine suitabilityforsurgicaltreatment.Neurosurgery.2015;77(5):698-708.
3. Fehlings MG,Nater A,Tetreault L, et al. Survival and clinical outcomes in surgically treated patients with metastatic epidural spinal cord compression: results of the prospective multicenter AO Spine study. J Clin Oncol. 2016; 34(3): 268-276.
4. Tomita K, Kawahara N, Kobayashi T, Yoshida A, Murakami H, Akamaru T. Surgical strategy for spinal metastases. Spine. 2001; 26(3): 298-306.
5. Tokuhashi Y, Matsuzaki H, Oda H, Oshima M, Ryu J. A revised scoring system for preoperative evaluation of metastatic spine tumor prognosis. Spine. 2005;30(19): 2186-2191.
6. Nater A, Tetreault L, Davis AM, Sahgal A, Kulkarni AV, Fehlings MG. Key preoperative clinical factors predicting outcome in surgically treated patients with metastatic epidural spinal cord compression: results from a survey of 438 AO Spine International Members.World Neurosurg. 2016;93: 436-448. e15.
7. Tobin NP, Foukakis T, De Petris L, Bergh J. The importance of molecular markers for diagnosis and selection of targeted treatments in patients with cancer. JInternMed.2015;278(6):545-570.
8. Chakravarthi BV, Nepal S, Varambally S. Genomic and epigenomic alterations incancer.AmJPathol.2016;186(7):1724-1735.
9. Mok T, Ladrera G, Srimuninnimit V, et al. Tumor marker analyses from the phase III, placebo-controlled, FASTACT-2 study of intercalated erlotinib with gemcitabine/platinum in the first-line treatment of advanced non-small-cell lung cancer.LungCancer.2016;98:1-8.
10. Olaussen KA, Postel-Vinay S. Predictors of chemotherapy efficacy in non-small cell lung cancer: a challenging land scape. AnnOncol. 2016; 27(11): 2004-2016.
11. Ito K, Hataji O, Kobayashi H, et al. Sequential therapy with crizotinib and alectinibinalk-rearrangednon-small-celllungcancer-amulticenterretrospective study.JThoracOncol.Inpress.
12. Schmidinger M, Wittes J. First-line treatment of metastatic renal cell carcinoma after COMPARZ and PISCES.CurrOpinUrol. 2015; 25(5):395-401.
13. Margolin K. The promise of molecularly targeted and immunotherapy for advanced melanoma. Curr Treat Options Oncol.2016;17(9):48.
14. Hernandez-Fernandez A, Velez R, Lersundi-Artamendi A, Pellise F. External validity of the Tokuhashi score in patients with vertebral metastasis. J Cancer Res ClinOncol.2012;138:1493-1500.
15. Quraishi NA, Manoharan SR, ArealisG, et al. Accuracy of the revised Tokuhashi score in predicting survival in patients with metastatic spinal cord compression (MSCC). EurSpine J. 2013;22(1):21-26.
16. Choi D, Crockard A,Bunger C, et al. Review of metastatic spine tumour classification and indications for surgery: the consensus statement of the Global Spine Tumour Study Group. Eur Spine J.2010; 19(2): 215-222.
17. Lee CH, Chung CK, Jahng TA, et al. Which one is a valuable surrogate for predicting survival between Tomita and Tokuhashi scores in patients with spinal metastases? Ameta-analysis for diagnostic test accuracy and individual participant dataanalysis. J Neurooncol. 2015;123(2): 267-275
18. Laufer I, Iorgulescu JB, Chapman T, et al. Local disease control for spinal metastases following "separation surgery" and adjuvant hypofractionated or highdose single-fraction stereotactic radiosurgery: outcome analysis in 186 patients. J NeurosurgSpine.2013;18(3):207-214.
19. Jabbari S, Gerszten PC, RuschinM, LarsonDA, LoSS, Sahgal A. Stereotactic body radiotherapy for spinal metastases: practice guidelines, outcomes, and risks. CancerJ. 2016; 22(4): 280-289.
20. Redmond KJ, LoSS, Fisher C, Sahgal A. Postoperative stereotactic body radiation therapy (sbrt) for spine metastases: a critical review to guide practice. Int J Radiat OncolBiolPhys.2016; 95(5): 1414-1428.
21. Knisely J, Sahgal A, LoS, MaL, Chang E.Stereotacticradiosurgery/stereotactic body radiation therapy-reflection on the last decade’s achievements and future directions. Ann Palliat Med.2016;5(2):139-144.
22. Sahgal A, Whyne CM, MaL, Larson DA, Fehlings MG. Vertebral compression fracture after stereotactic body radiotherapy for spinal metastases. Lancet Oncol. 2013;14(8):e310-e320.
23. Xie P, Zhao Y, Li G. Efficacy of percutaneous vertebroplasty in patients with painful vertebral metastases: a retrospective study in 47 cases. ClinNeurol Neurosurg. 2015;138:157-161.
24. Jang JS, Lee SH. Efficacy of percutaneous vertebroplasty combined with radiotherapy in osteolytic metastatic spinal tumors. J Neurosurg Spine. 2005; 2(3): 243248.
25. Qian Z, Sun Z, Yang H, Gu Y, Chen K, WuG. Kyphoplasty for the treatment of malignant vertebral compression fractures caused by metastases. J Clin Neurosci. 2011;18(6): 763-767.
26. Li D, Huang Y, Yang H, et al. Jack vertebral dilator kyphoplasty for treatment of osteoporotic vertebral compression fractures. Eur J OrthopSurgTraumatol. 2014;24(1):15-21.
27. Werner CM, Osterhoff G, Schlickeiser J, et al. Vertebral body stenting versus kyphoplasty for the treatment of osteoporotic vertebral compression fractures: a randomizedtrial. J Bone Joint SurgAm.2013;95(7):577-584.
28. Gevargez A, Groenemeyer DH. Image-guided radiofrequency ablation (RFA) of spinaltumors.EurJRadiol.2008;65(2):246-252.
29. Nakatsuka A, Yamakado K, Takaki H, et al. Percutaneous radiofrequency ablation of painful spinal tumors adjacent to the spinal cord with real-time monitoring of spinal canal temperature: a prospective study. CardiovasInterv Radiol. 2009; 32(1):70-75.
30. Huang TJ, Hsu RW, Li YY, Cheng CC. Minimal access spinal surgery(MASS) in treating thoracic spine metastasis. Spine.2006;31(16): 1860-1863.
31. Yang Z, Yang Y, Zhang Y, et al. Minimal access versus open spinal surgery in treating painful spine metastasis: a systematic review. World J Surg Oncol. 2015;13:68.
32. Molina CA, Gokaslan ZL, Sciubba DM. A systematic review of the current role of minimally invasive spine surgery in the management of metastatic spine disease. Int J Surg Oncol. 2011; 2011: 598148.
33. Ozkan N, Sandalcioglu IE, Petr O, et al. Minimally invasive transpedicular dorsal stabilization of the thoracolumbar and lumbar spine using the minimal access non traumatic insertion system (MANTIS): preliminary clinical results in 52 patients. J Neurol Surg Part A. 2012;73(6): 369-376.
34. Saigal R, Wadhwa R, Mummaneni PV, Chou D. Minimally invasive extracavitary transpedicular corpectomy for the management of spinal tumors. Neurosurg Clin N Am.2014;25(2): 305-315.
35. Huang TJ, Hsu RW, Liu HP, et al. Video-assisted thoracoscopic surgery to the upper thoracic spine.Surg Endosc.1999; 13(2): 123-126.
36. Kan P, Schmidt MH. Minimally invasive thoracoscopic approach for anterior decompression and stabilization of metastatic spine disease. Neurosurg Focus. 2008;25(2):E8.
37. Ragel BT, Amini A, Schmidt MH. Thoracoscopic vertebral body replacement with an expandable cage after ventral spinal canal decompression. Neurosurgery. 2007; 61(5suppl2): 317-322.
38. Verlaan JJ, Choi D, Versteeg A, et al. Characteristics of patients who survived<3 Monthsor>2 years after surgery for spinal metastases: can we avoid in appropriate patient Selection? J Clin Oncol. 2016; 34(25): 3054-3061.
39. Dhall SS, Wang MY, Mummaneni PV. Clinical and radiographic comparison of mini-open transforaminal lumbar interbody fusion with open transforaminal lumbar interbody fusion in 42 patients with long-term follow-up. J Neurosurg Spine.2008;9(6):560-565.
40. Kim CH, Chung CK, Sohn S, Lee S, Park SB. Less invasive palliative surgery forspinalmetastases.JSurgOncol.2013;108(7):499-503.
41. Frankel BM, Jones T, Wang C. Segmental polymethylmethacrylate-augmented pedicle screw fixation in patients with bone softening caused by osteoporosis and metastatic tumor involvement: a clinical evaluation. Neurosurgery. 2007; 61(3): 531537.
42. Elder BD, Lo SF, Holmes C, et al. The biomechanics of pedicle screw augmentation with cement. Spine J. 2015; 15(6):1432-1445.
43. Gazzeri R,Roper to R,Fiore C.Surgical treatment of degenerativeandtraumatic spinaldiseaseswithexpandablescrewsinpatientswithosteoporosis:2-year follow up clinical study.JNeurosurg Spine. 2016; 17:1-10.
44. Aebi M.Spinal metastasis in the elderly. Eur Spine J. 2003; 12(suppl2): S202-S213.
45. Fitzpatrick D, Grabarz D, Wang L, et al. How effective is a virtual consultation process in facilitating multidisciplinary decision-making for malignant epidural spinal cord compression? Int J Radiat Oncol Biol Phys. 2012; 84(2): e167-e172.
46. Fisher CG, DiPaola CP, Ryken TC, etal. A novel classification system for spinal instability in neoplastic disease: an evidence based approach and expert consensus from the Spine Oncology Study Group. Spine. 2010; 35(22):E1221-E1229.
47. Fourney DR, Frangou EM, Ryken TC, et al. Spinal Instability Neoplastic Score: ananalysis of reliability and validity from the Spine Oncology Study Group.J Clin Oncol.2011; 29(22):3072-3077.
48. VersteegAL, Verlaan JJ, Sahgal A ,et al.The Spinal Instability Neoplastic Score: impact ononcologic decision-making. Spine.2016;41(suppl20):S231-S237.
49. Jackson JB, 3rd, Crimaldi A, Peindl R, Norton HJ, Anderson WE, Patt JC. The effect of poly etheretherketoneon the rapeuticradiationtothe spine-apilot study. Spine. Inpress.
50. Salem KMI, Fisher CG. Anterior column reconstruction with PMMA: an effective long-term alternative in spinal oncologic surgery. Eur Spine J. 2016;25(12): 3916-3922.
51. Xu N, Wei F, Liu X, et al. Reconstruction of the upper cervical spine using a personalized 3d-printed vertebral body in an adolescent with Ewing sarcoma. Spine.2016;41(1):E50-E54.
52. Noriega DC, Hernandez-Ramajo R, Rodriguez-Monsalve Milano F, et al. Risk benefit analysis of navigation techniques for vertebral transpedicular instrumentation: a prospective study. Spine J. Inpress.
53. Fujishiro T, Nakaya Y, Fukumoto S, et al. Accuracy of pedicle screw placement with robotic guidance system: a cadaveric study. Spine. 2015;40(24): 1882-1889.





 京公网安备11010502051256号
京公网安备11010502051256号