小鼠颅窗模型中特立帕肽疗法通过对新骨形成的合成代谢作用以及对肥大细胞抑制的非合成代谢作用改善骨缺损愈合
2017-09-19 文章来源:丁悦 林思鹏(中山大学孙逸仙纪念医院骨外科) 我要说
来源:Journal of Bone and Mineral Research
期刊年卷:Journal of Bone and Mineral Research, Vol. 32, No. 9, September 2017, pp 1870–1883
作者:Longze Zhang, Tao Wang, Martin Chang, Claire Kaiser, Jason D Kim, Tianyu Wu, Xiaoyi Cao, Xinping Zhang, and Edward M Schwarz
背景介绍:
严重骨缺损的临床治疗目前依然面临许多挑战,而重组甲状旁腺激素(rPTH,特立帕肽)具有良好的合成代谢作用,可作为针对严重骨缺损的辅助治疗。同时,rPTH疗法还具有非合成代谢作用,可通过改变血管分布及抑制纤维化从而加快骨愈合。
研究表明,血管生成素-1增强血管生成(直径<30mm的血管)和抑制动脉生成(血管直径>30mm)能促进活体自体移植的成功,而高水平的血管生成素-2促进了动脉生成和纤维化则会导致同种异体移植的失败。在同种异体移植的第7天,rPTH疗法可以抑制动脉生成和纤维化,而抗血管生成素-2抗体治疗也同样有这种抑制作用,这证明动脉生成和纤维化对骨再生有不良影响。
在小鼠股骨和颅骨同种异体移植的愈合过程中,rPTH疗法消除了积聚在移植物-宿主结合处大血管周围的大量肥大细胞。在骨折愈合的早期阶段,肥大细胞可消化细胞外基质及抑制血管生成。而且由于参与了一些炎性因子的脱粒和释放,肥大细胞可诱导慢性纤维化。肥大细胞具有TGFb1介导的纤维化作用以及抗调节作用,可成为一些肌肉骨骼疾病的潜在诱因(例如:腱蛋白病,炎性肌病等),这进一步提示它会导致组织修复的失败。
基于上述数据,我们认为rPTH疗法的非合成代谢作用体现在它对肥大细胞积累的抑制。所以我们建立了一种慢性颅骨缺损窗口模型,该模型可使用体内多光子激光扫描显微镜(MPLSM)进行定量分析,并可观察骨修复期间骨形成和血管生成的自然过程。此外,该方法还可运用转基因菌株进行谱系追踪和功能缺陷研究。
方法:
使用动物和活体实验的方法,并建立标准的颅骨缺损模型进行研究。所有实验小鼠在研究开始时都小于2个月,体重范围在20到24克,把这些小鼠随机分配到不同的治疗组中。然后开展四个独立的活体实验,分别为:实验一:评估rPTH组和色甘酸钠(SC)组对血管和骨形成的影响与安慰剂组相比有何差异。实验二:评估严重骨缺损模型中肥大细胞积累与血管生成之间的关系。实验三:通过直接荧光MPLSM确认rPTH疗法对肥大细胞数量的影响。实验四:证明严重骨缺损愈合过程中肥大细胞功能损失对新骨形成和血管形成的影响。
运用纵向μCT扫描来显示缺损愈合与新骨量的情况。运用纵向MPLSM对颅骨损伤愈合期间血管生成和动脉发生进行评估,并运用阿米拉6.0系统进行图像分析。使用Amira软件对血管的长度和直径进行量化,以及对新骨量进行分段,分类和量化。选择Mcpt5-Cre-YFP转基因小鼠进行实验,并对颅骨缺损术后7天的Mcpt5-Cre-YFP小鼠进行颅骨组织切片的免疫组织化学分析,以验证在小鼠模型中YFP信号是肥大细胞的标记,从而通过MPLSM信号进行肥大细胞的计数。使用Mcpt5-iDTR转基因小鼠进行实验,在术后立即给予小鼠DTA或安慰剂,并运用抗Mcpt5-FITC抗体进行间接MPLSM,以验证DTA介导的肥大细胞缺失,从而在颅骨缺损窗模型中直接显示出肥大细胞功能的缺失对骨愈合和血管形成的影响。运用单独处理MC/9细胞,或与7F2细胞共同培养的方法,评估rPTH对肥大细胞活力的直接和间接影响。除此之外,还有体外rPTH刺激和RNA测序、统计分析等方法。
结果:
1.抑制肥大细胞可加快严重颅骨缺损愈合并抑制动脉生成。
纵向μCT显示,SC组的骨缺损愈合显著加快,是安慰剂组的1.4倍,且在术后28天其新生骨量也增加到安慰剂组的1.4倍(图1)。不过rPTH组在加快骨缺损闭合及促进新骨形成方面的效果比SC组更好。术后14天rPTH组与安慰剂组相比,骨缺损闭合及新骨形成均明显加快;术后28天与SC组相比仍然显示出更好的效果(图1)。图1L显示,根据纤维组织的体积可观察到,在术后29天rPTH组和SC组纤维组织的形成都显着降低。
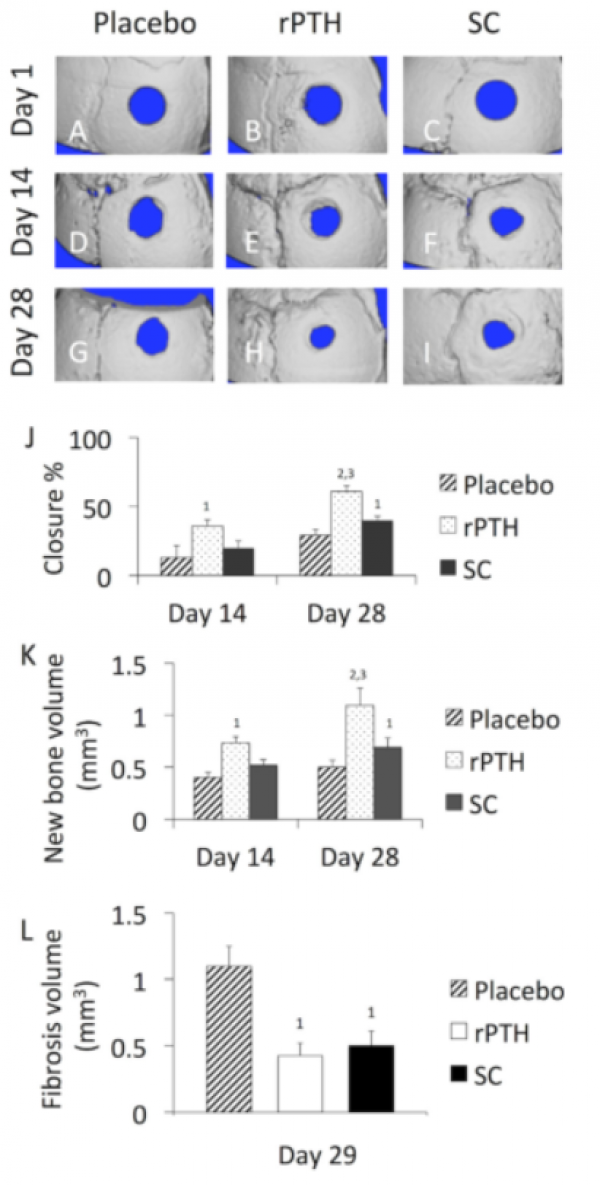
Figure 1
MPLSM对血管形成过程的纵向评估显示,rPTH组和SC组对骨缺损愈合期间血管新生和动脉生成(图2A-F)造成的影响大致相同(图2)。图2G显示,术后15天各组之间没有明显的差异,但图2H显示,术后29天与安慰剂组相比,SC组与rPTH组颅骨缺损处的小血管数量均显着降低,大血管的数量有所增加,而其中rPTH组的表现更为明显。在rPTH组中,小血管和大血管数量的变化是相对应的,所以rPTH组与安慰剂组的总体血管体积在任一时间点没有显着差异(图2I,J)。图I与J也显示,在所有时间点上,各组间的总血管长度没有差异,但术后29天SC组与安慰剂组相比总血管体积明显下降。
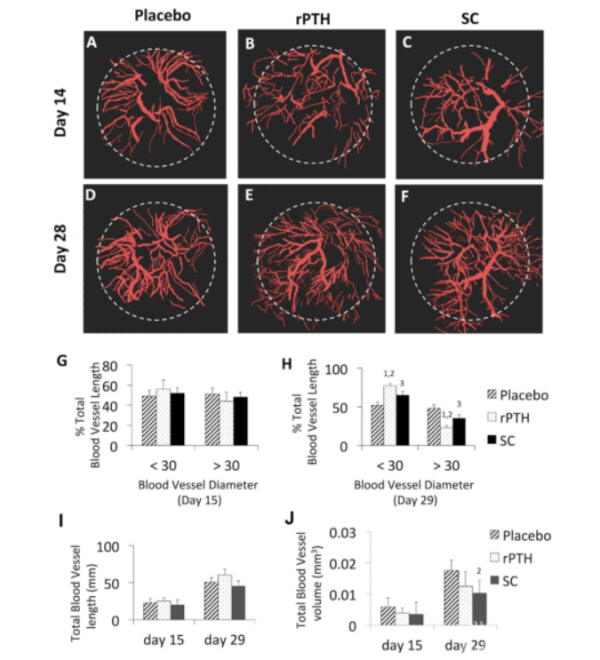
Figure 2
2.损伤后的24小时内,肥大细胞于颅骨缺损边缘积聚,标志着1周后会出现血管生成。
纵向间接免疫荧光MPLSM实验结果显示(图3A-1),在损伤后24小时内可观察到骨缺损边缘周围存在着大量肥大细胞(图3A)。肥大细胞的数量在术后约1周时达到峰值,此时可在颅骨缺损中首次检测到新血管生成(图3C,C′)。动脉生成则在术后17天开始出现(图3E),并且在接下来的整个实验中一直存在(图3E,F)。因此,这些研究结果表明,虽然肥大细胞的积累与动脉生成是相互独立的,不过肥大细胞可能有助于严重骨缺损愈合过程中的动脉生成。
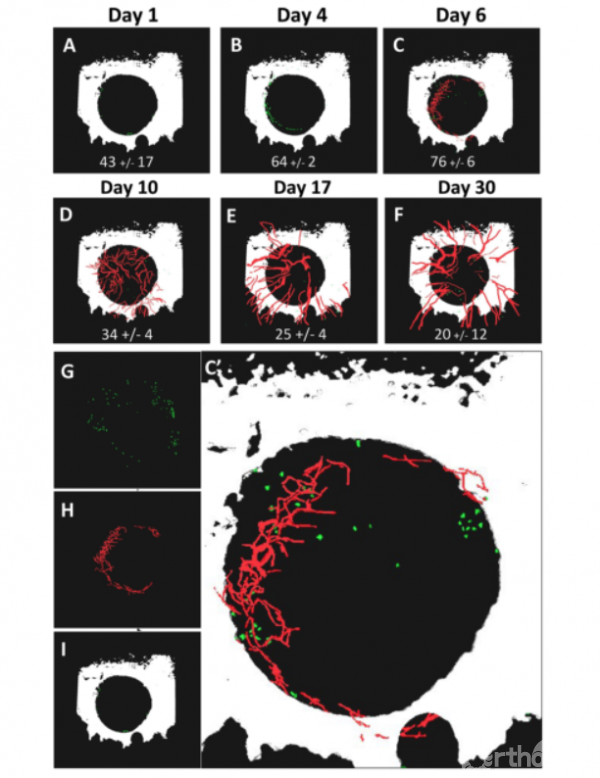
Figure 3
3.在骨愈合过程中,rPTH减少了严重骨缺损中肥大细胞的数量。
对颅骨缺损术后第7天的Mcpt5-Cre-YFP小鼠的颅骨组织切片进行免疫组织化学分析(图4A-H),结果显示:细胞质直接荧光(YFP)和间接荧光(FITC-缀合的抗Mcpt5免疫活性)在肥大细胞核周围有明显的共同定位(图4B,C,F,G)。
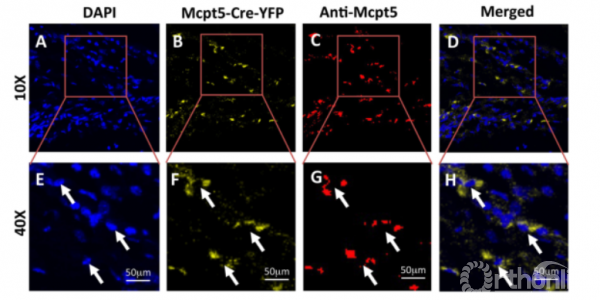
Figure 4
通过在亮视野和暗视野上的组织学研究,进一步确认YFP信号可作为肥大细胞的标记(图5A-F)。利用直接荧光MPLSM分别测定rPTH组与安慰剂组中Mcpt5-Cre-YFP小鼠的肥大细胞数量(图5G,H),结果显示:在颅骨缺损的边缘存在着类似数量的YFP+肥大细胞(图5G)。这一发现不仅验证了间接荧光MPLSM实验,而且排除了抗肥大细胞抗体的影响。
此外,颅骨缺损中肥大细胞的定量结果(图5H)显示,术后1天和14天rPTH组与安慰剂组相比,肥大细胞数量显著降低(p<0.05)。然而,在术后第28天两组的肥大细胞数量无明显差异,这表明rPTH的免疫调节作用仅限于骨愈合的炎症期。

Figure 5
4.肥大细胞缺失可加快严重骨缺损愈合并抑制动脉生成。
骨愈合的纵向μCT评估结果显示,与安慰剂组相比,DTA介导的肥大细胞缺失显著加快骨缺损闭合和新骨形成(图6A-F)。MPLSM结果显示,与安慰剂组相比,DTA介导的肥大细胞缺失显著增加血管生成并减少动脉发生和纤维化(图6G,H)。DTA疗法在骨形成(图6E,F),血管形成(图6I)和纤维化(图6J)等方面对Mcpt5-iDTR转基因小鼠产生的影响与SC疗法在这些方面对WT小鼠的影响相似(图1和2)。
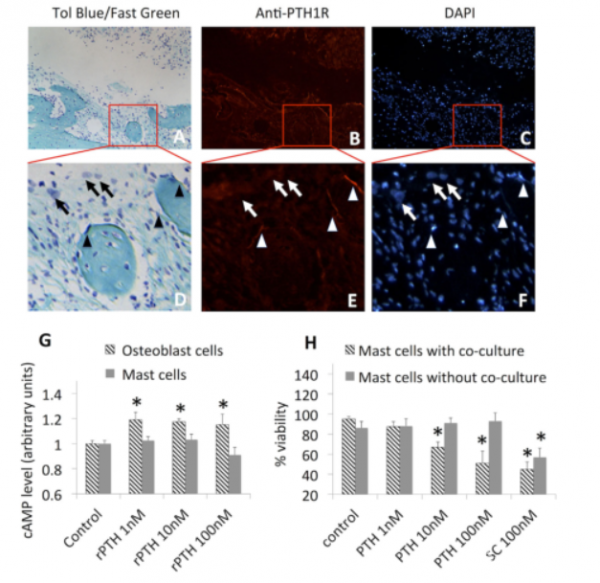
Figure 6
5.rPTH通过成骨细胞间接抑制肥大细胞。
我们对7F2和MC/9细胞进行了实时定量的RT-PCR研究,结果显示,在成骨细胞中可检测到PTHⅠ型受体表达而在肥大细胞中则检测不到。对BIOGPS(www.BIOGPS.org)数据库中的转录组数据进行计算机分析的结果也同样证明,在肥大细胞中检测不到PTHⅠ型受体转录物。对小鼠颅骨窗组织进行免疫组化实验的结果显示:在成骨细胞中,对甲苯胺蓝染色呈阳性,而在肥大细胞中则无免疫反应性(图7A-F)。体外功能研究测验的相关研究结果表明rPTH间接作用于肥大细胞,而且是成骨细胞的rPTH刺激诱导抗肥大细胞因子生成。(图7G、H)

Figure 7
通过对7F2和MC/9共培养物进行RNAseq分析及文献查阅,初步确定11种肥大细胞基因在经rPTH处理的共培养物中有不同程度表达(表1),这些基因被分为四组:(1)与纤维化相关的基因,包括Igsf10,Ifi44,Pde8a;(2)与凋亡相关的基因,包括Cecr2;(3)与血管形成相关的基因,包括Thbs2和Gm8692;(4)其余的基因,它们的功能我们目前尚未知悉。这些基因的诱导一经证实,我们就可以通过骨修复过程中的功能研究,来评估这些基因的作用。

Table 1
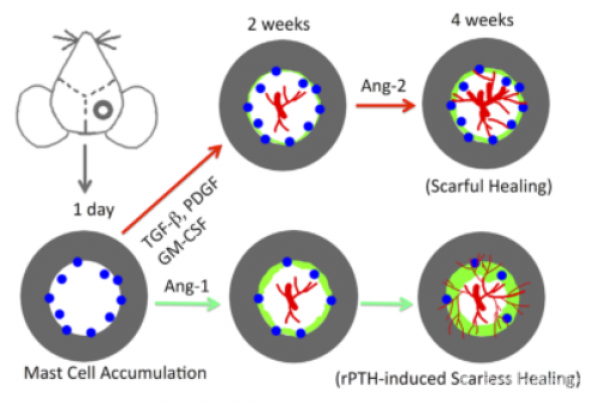
Figure 8
结论:
通过在颅骨缺损模型中,SC组与rPTH组疗效的比较,证明特立帕肽对骨愈合具有合成代谢作用和非合成代谢作用,也证明SC组(图1)中骨愈合的加快源于合成代谢药物对间充质祖细胞和成骨细胞的影响。此外,SC组与rPTH组相比,对动脉生成的抑制作用不大(图2J),可能是由于其具有对肥大细胞颗粒稳定的特异性作用,而rPTH组则可直接降低肥大细胞数量(图5)。结果表明,rPTH的非合成代谢作用主要是由于一些促炎症介质和促纤维化介质的缺失。基于这一新信息,我们提出了一种瘢痕愈合模型,用来与rPTH介导的无瘢痕愈合作比较。(图8)结果表明,损伤初期肥大细胞的积聚不需要大型血管(图3)。与瘢痕愈合相反,在炎症阶段,rPTH诱导的无瘢痕愈合的特征是有少量肥大细胞存在(图5)以及血管生成素1和2的相互表达。因此,rPTH可显着加快新血管生成(图2),从而促进新骨形成。
综上所述,这些研究结果表明,肥大细胞可通过刺激动脉生成以及纤维化瘢痕生成来抑制骨缺损愈合,而rPTH疗法则因其对骨修复有效的非合成代谢作用,可对肥大细胞导致的动脉生成和纤维化产生抑制作用,从而促进骨愈合。





 京公网安备11010502051256号
京公网安备11010502051256号