【奇案求真】这例胸椎巨大骨巨细胞瘤是如何切除并固定椎体的?
2017-07-12 文章来源:北医三院骨科 韦峰 我要说
骨巨细胞瘤最常见的原发性脊柱肿瘤之一。占全身骨巨细胞瘤的10%左右,占脊柱原发性肿瘤的近20% 。该肿瘤以溶骨性病变为主,一般被归类为良性,但其常破坏骨皮质及周围软组织,具有侵袭性等恶性肿瘤特征。
过去习惯依据肿瘤组织中基质的多少将巨细胞瘤分为Ⅰ、Ⅱ、Ⅲ级,认为Ⅰ、Ⅱ级偏向良性,Ⅱ、Ⅲ级偏向恶性,实践表明这种分级与临床实际情况并不完全符合,故现在已很少有人再作分级。
巨细胞瘤可侵及脊柱各个节段,以侵及骶骨者相对较多,脊椎前后部结构均可受累,部分病例仅见椎体病变。巨细胞瘤有转移或自发恶变的可能,发生率较低。
临床表现以疼痛为主,因肿瘤侵及椎管引起脊髓及神经根损害症状者也不少见。
X线片显示椎体内膨胀性破坏,典型者呈“肥皂泡样”改变,边缘无硬化,一般不出现骨膜反应。发生于骶骨者多为偏心性生长。CT和MRI可清晰显示肿瘤范围、软组织团块及神经组织受压情况。放射性核素骨扫描显示病变部位为浓聚区,且浓聚多分布于病变周围部。
肿瘤由卵圆形、胖圆形、梭形的单核细胞以及平均分布的多核巨细胞组成。其中,梭形的基质细胞为肿瘤细胞。
治疗方案在过去30年没有太大变化。如果确定肿瘤是可切除的,手术是首选的治疗方法。 Enneking S2期肿瘤可以采取经留刮除。Enneking S3期肿瘤最好采取边缘或广泛的整块切除。
不适合手术的肿瘤患者可接受放射治疗,但需特别谨慎。因为绝大多数肉瘤变的复发性肿瘤当初都是良性病变但接受过放疗的。
用于骨巨细胞瘤的药物治疗包括双膦酸盐,例如唑来膦酸。该药物能诱导细胞凋亡,预防肿瘤诱发的骨质溶解。最近,针对RANK配体的单克隆抗体狄诺塞麦(Denosumab)在II期研究中已被用于治疗骨巨细胞瘤。这是基于通过特异性抗RANKL抗体对骨巨细胞瘤中的肿瘤细胞的抑制作用。
病例介绍:
患者女性49岁,因体检时发现左侧胸前占位,于当地医院检查发现T11椎体破坏性病变合并胸腔占位。为进一步诊治转入我院。查体未见下肢神经功能损害。

图1-2:2016年6月胸片及胸部CT提示左肺下叶不张,占位性病变。左侧胸腔积液。T11椎体骨质破坏。
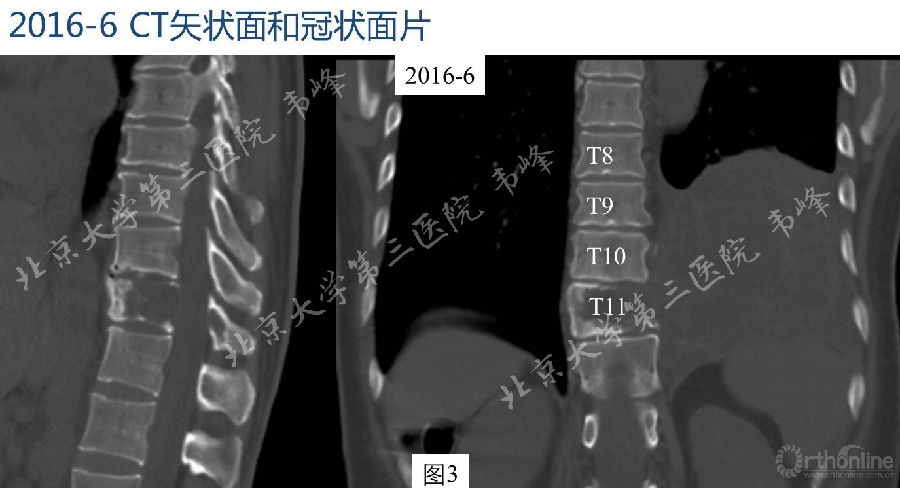
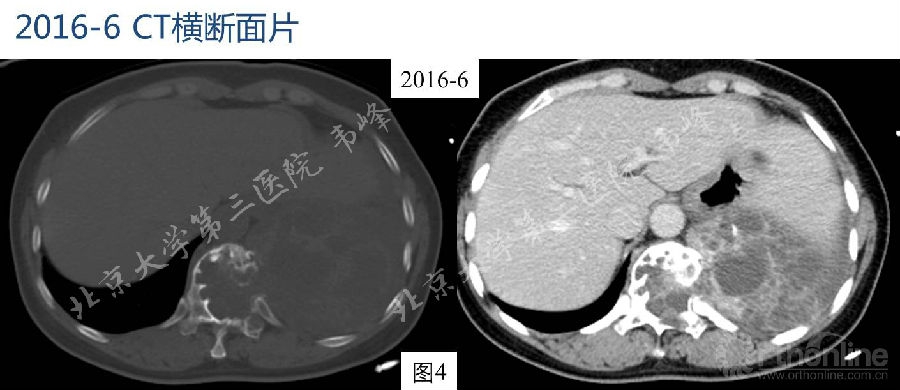
图3-4:2016年6月胸腰段CT检查显示,T11椎体及附件骨质膨胀性破坏,破坏区域边缘骨质部分硬化,破坏区及左侧胸腔见囊实性软组织密度肿块,部分突入椎管,硬膜囊及脊髓受压。肿块最大层面约78.2×123mm,其内见多发大小不等囊变,部分囊壁钙化。增强扫描实性部分明显强化,肿块包膜完整。

图5:胸腰段核磁检查显示:T11椎体及附件膨胀性骨质破坏,可见残留骨嵴,骨质破坏区及左侧胸腔混杂长T1、等T2为主信号肿块,部分肿块突入椎管,可见多发囊状长T2信号及液液平面,硬膜囊及脊髓轻度受压。增强扫描,实性部分明显强化。
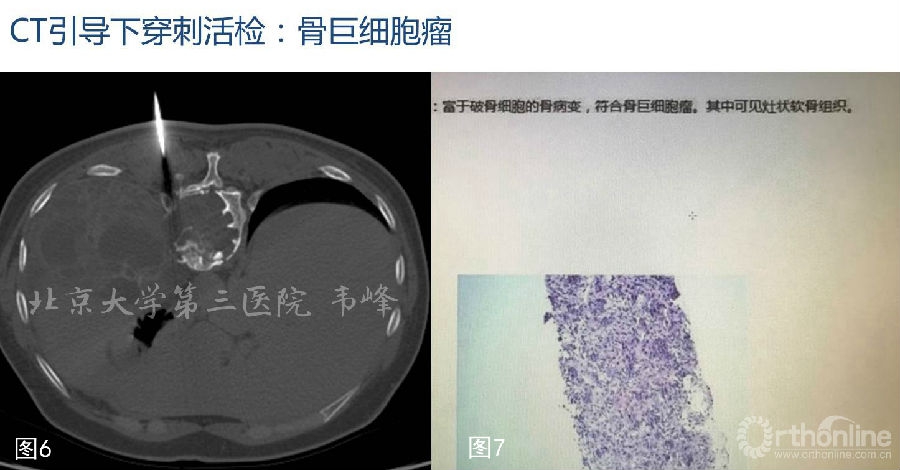
图6-7:CT引导下穿刺活检,病理结果提示肿瘤为骨巨细胞瘤。
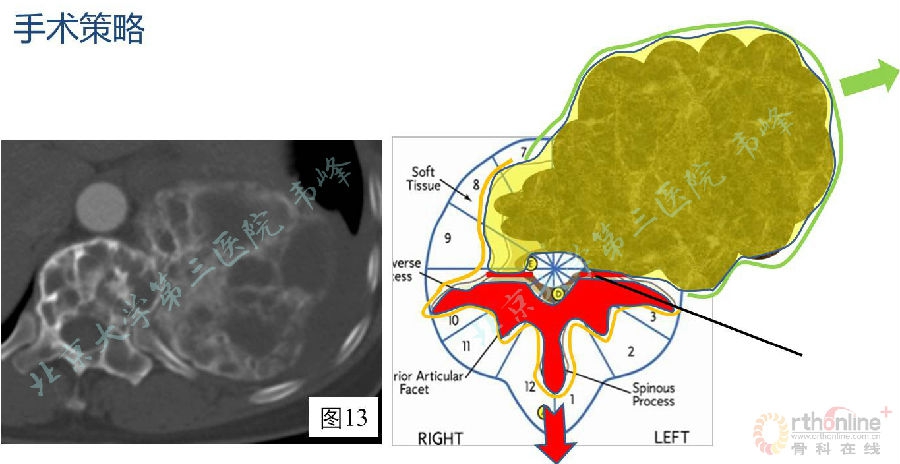
本例骨巨细胞瘤属于Enneking S3期,即属于侵袭性生长,应实施边缘性的整块切除。如果直接实施手术,面临的最大问题是如何选择截骨平面。
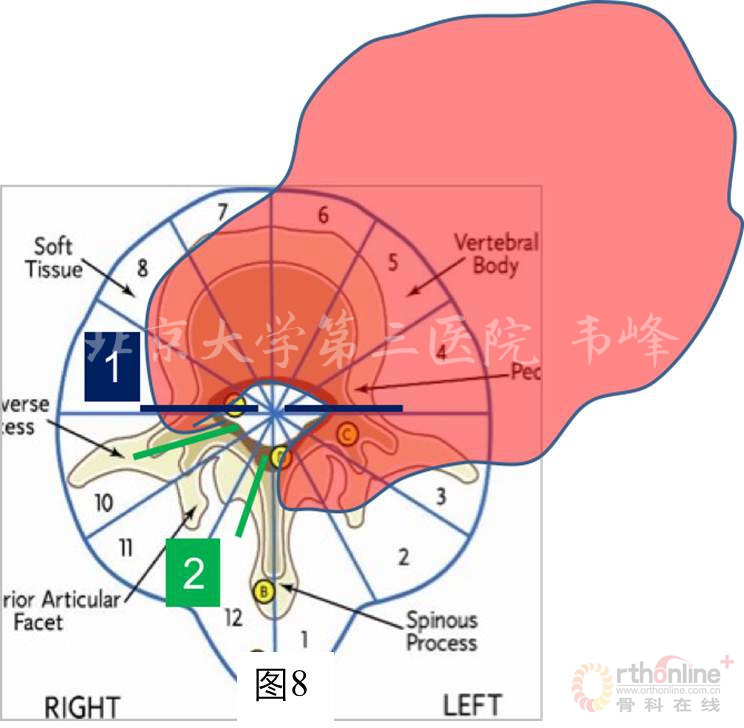
如图8所示,如果采用Tomita TES的经椎弓根截骨(1),将不可避免的在左侧椎弓根处经瘤,增加肿瘤细胞种植的风险。
如果采用WBB的截骨方式(2),将最大限度地避免经瘤,但操作难度大,而且截骨后由于肿瘤横跨整个椎体及左侧附件,肿瘤标本无论从后路还是从前路取出都非常困难。另外,由于肿瘤巨大,包膜质地柔软,所以在手术时很容易破裂。
小知识:
整块切除:是骨肿瘤的一种切除方式,与分块切除相对。整块切除意指将肿瘤作为一块地切除,肿瘤标本周围被一层完整的正常组织或假膜包绕,是局部切除最为彻底的方式。
全椎切除:全椎切除是解剖学概念,而不是肿瘤学概念。意指将整个椎体切除,可以是分块切除,也可以是整块切除。
根据最新的骨肿瘤NCCN指南,这种情况可让病人先接受狄诺塞麦治疗,待肿瘤体积缩小、边缘硬化后再实施整块切除,或甚至可以分块切除手术。
狄诺塞麦治疗:狄诺塞麦(Denosumab)是由美国安进(Amgen)公司生产,通过特异性抗RANKL抗体对骨巨细胞瘤中的肿瘤细胞达到抑制作用的一种药物。2013年,美国FDA批准狄诺塞麦用于治疗成人和某些青少年的复发及难治性骨巨细胞瘤。
经过狄诺塞麦治疗后,骨巨细胞瘤的坏死率可达90%。此时可实施手术,可大大降低肿瘤细胞的种植风险,因此,为了降低手术难度,减少并发症,部分病人可采取分块切除的方式,即所谓的降级手术。
遗憾的是目前大陆该药物尚处于上市前的临床观察期,如需用药,需要病人前往香港或台湾购买。
医嘱病人用狄诺塞麦治疗3个月后复查,如果肿瘤缩小,再考虑实施手术。但是由于购药困难,患者于2016年10月尚未开始用药,复查时发现肿瘤明显增大。
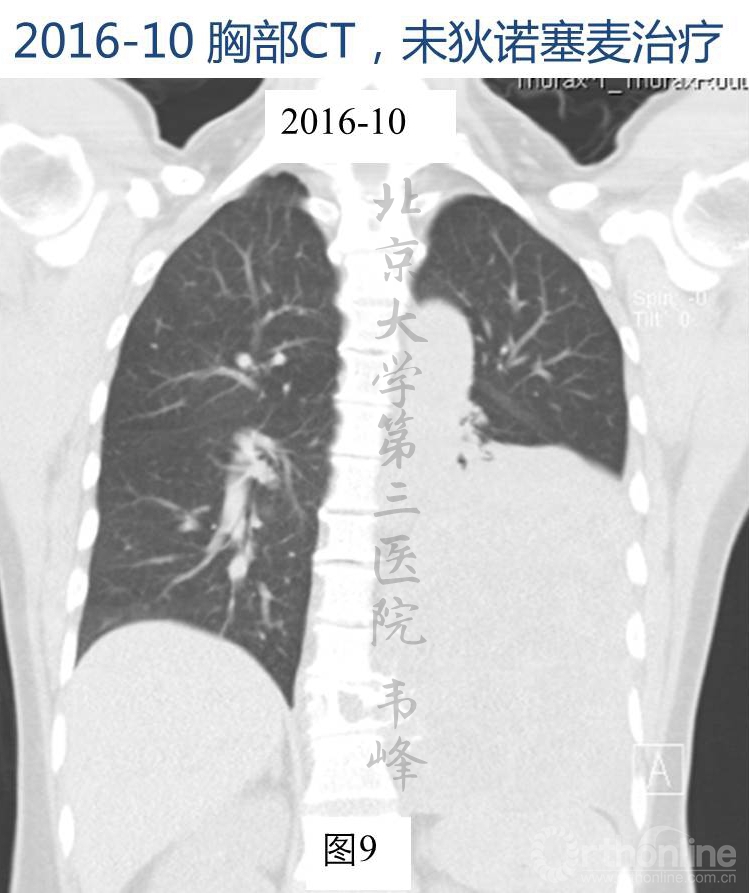
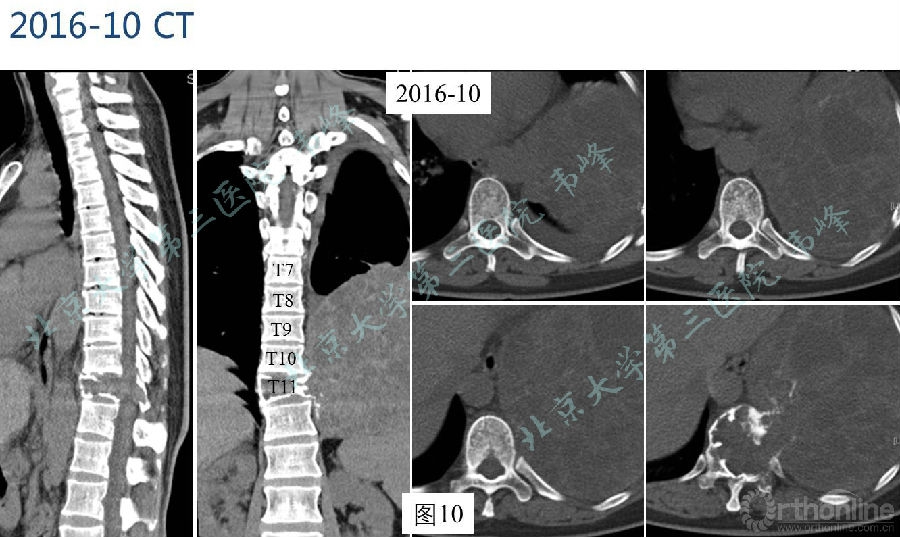
图9-10:2016年10月胸腰椎CT显示肿瘤较4个月前明显增大,肿块最大层面约13.2×14.7cm。左肺体积缩小。
随后病人设法从海外买到狄诺塞麦,用药后3个月复查。
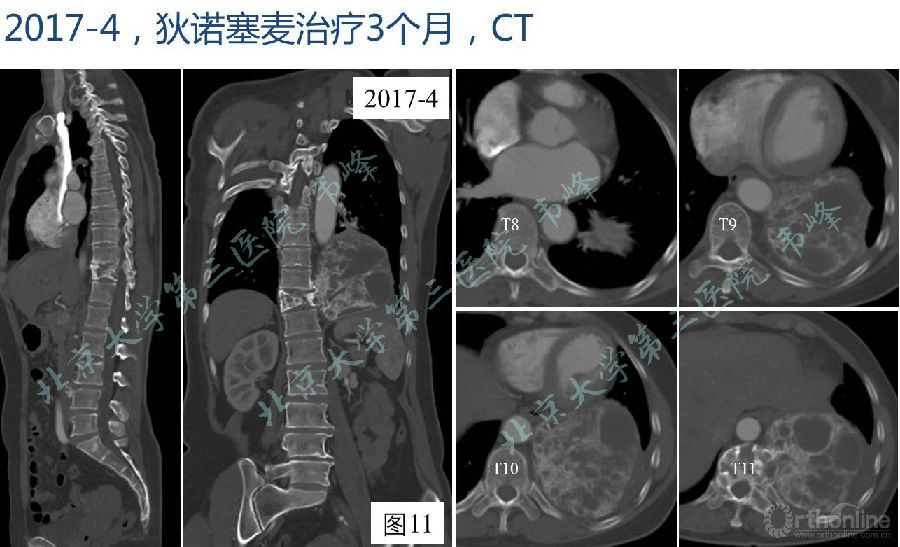
图11:2017年2月胸腰段CT显示破坏区边缘骨质明显硬化,局部及左侧胸腔软组织肿块体积明显缩小,大小约88×90×83mm。
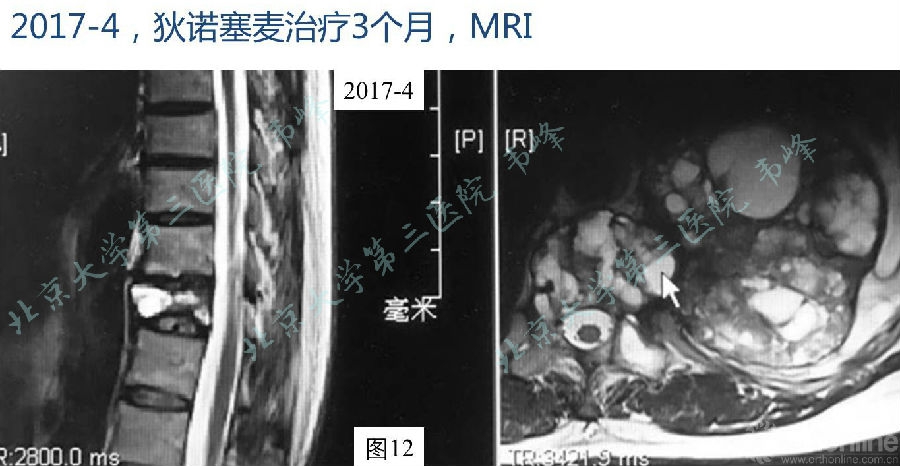
图12:2017年2月胸腰段MRI显示T11椎体较前压缩,硬膜囊受压较前缓解,左侧胸腔混杂信号肿块较前局限,低信号包膜明显,病变内液液平面较前减少。
此时分析病人的CT片可见,左侧附件区的骨质明显修复。这时选取Tomita截骨,将T11附件作为一整块地切除,然后将椎体和肿瘤的主体从前方取出,这样会大大降低手术的难度和风险,而且由于用药后附件区域的肿瘤坏死、骨组织修复明显,经椎弓根截骨造成肿瘤细胞种植的风险大大降低。
如图13所示,手术分二期进行,第一期手术为后路,用线锯切断双侧T11椎弓根,将T11附件整块切除。在切除右侧T11-12肋骨近端后,剥离右侧胸膜直达椎体前方,用挡板将主动脉遮挡在前方。从双侧进行T10-11和T11-12的椎间盘切除,前、后纵韧带的切除。这样T11椎体即得到完全的游离。安装好后路的连接棒后手术即结束。
第二期手术在一周后。采取右侧卧位,左侧肋间入路。切口根据肿瘤最大径的体表投影确定。首先在胸科医生的帮助下打开胸腔,分离肿瘤与肺、膈、主动脉的粘连。然后将肿瘤连带T11椎体整块切除。T11椎体切除后用事先做好的3D打印人工椎体修复前柱。由于双侧的胸腔剥离,双侧均有不同程度的胸膜撕裂,因此术后安装双侧的胸腔闭式引流。
病人于术后第三天,带闭式引流下地活动。病情平稳,顺利出院。术后定期复查,无需辅助治疗。
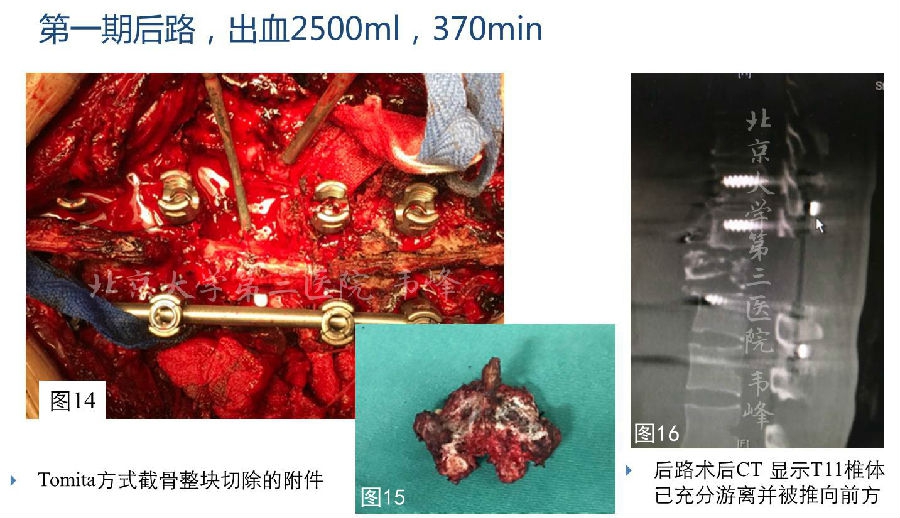
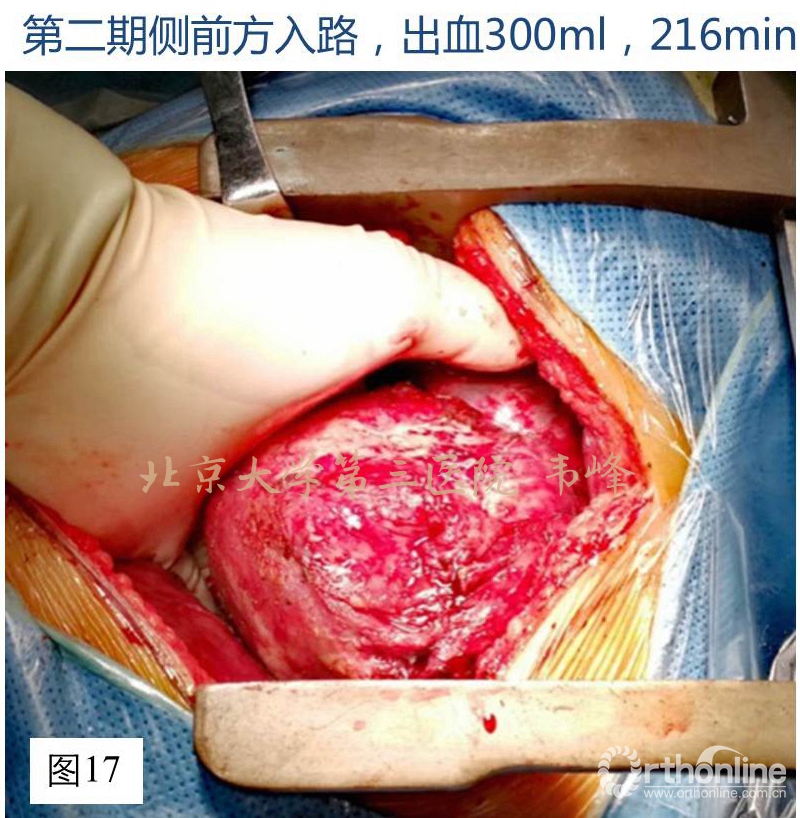
图14-17:术中照片显示将椎体与神经结构充分游离。整块切除的附件结构。术后CT显示T11椎体得到充分的游离,并在术中将其推向前方,以便在前路手术时取出。

图18:术后标本和标本的CT扫描。术后病理提示附件区域内未见肿瘤细胞。椎体内病变符合骨巨细胞瘤狄诺塞麦治疗后改变。

图19:定制的3D打印人工椎体,从前方植入,并通过侧翼上的钉孔用4.5mm松质骨螺钉固定于相邻椎体。
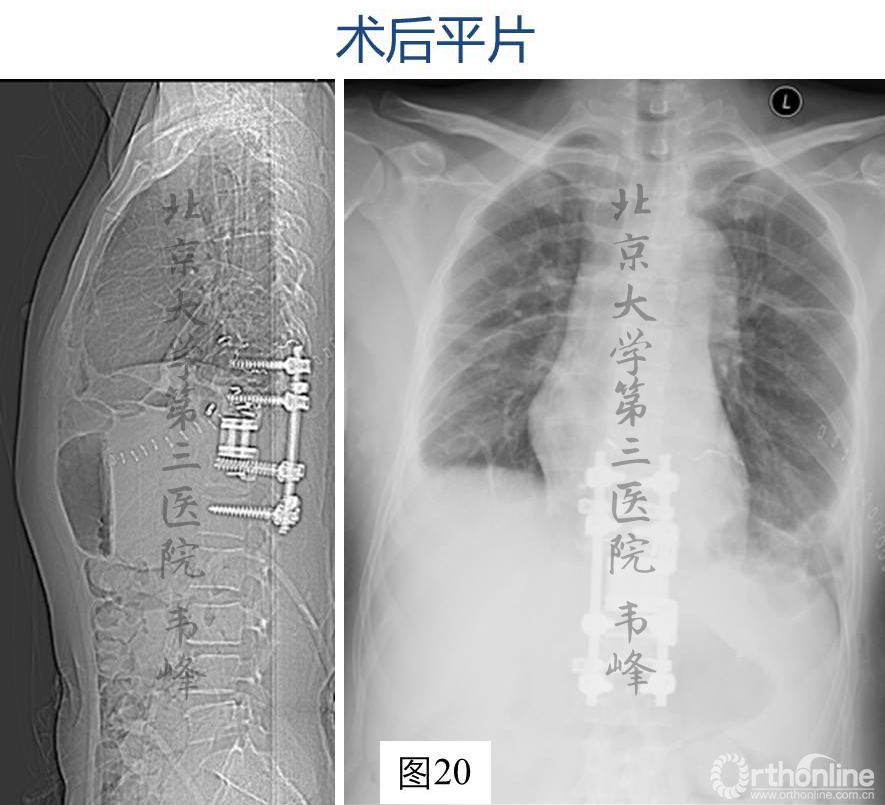
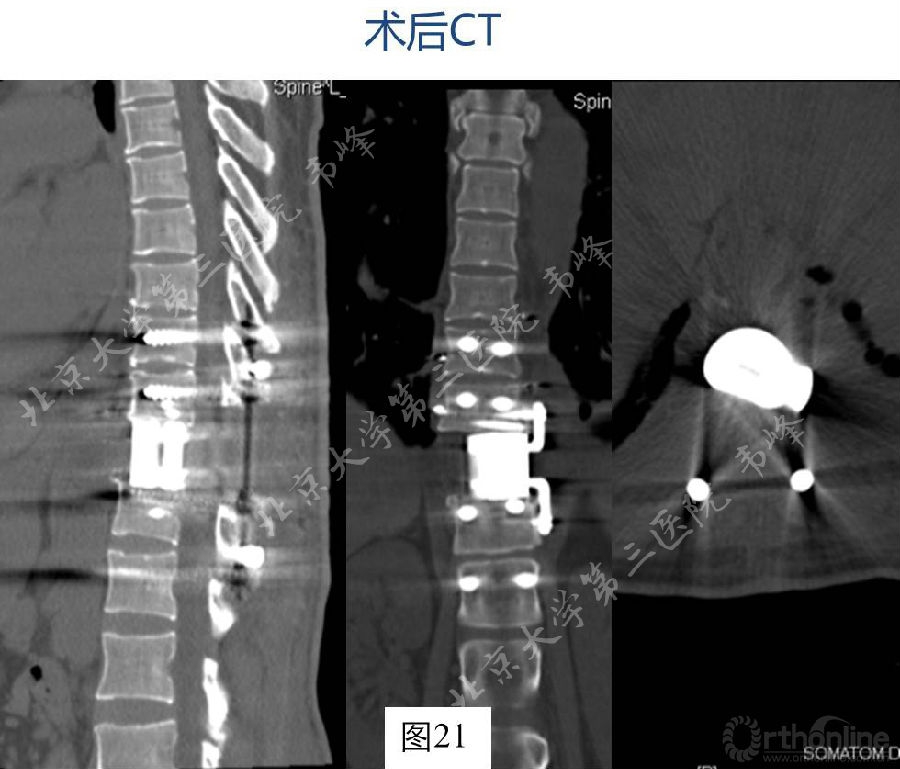
图20-21:术后X及CT片,显示内固定稳固。
作者简介:

韦峰
韦峰,医学博士。
北京大学第三医院骨科主任医师,副教授,硕士生导师。
中国修复重建外科专业委员会骨肿瘤专业学组副组长;AOSpineKnowledge Forum Tumor, associate member;AOSpine中国讲师;中国医师学会肿瘤医师分会青年医师委员会委员;《中国脊柱脊髓杂志》青年编委。
专长:脊柱肿瘤,脊柱退变性疾病,脊柱微创手术。





 京公网安备11010502051256号
京公网安备11010502051256号