释放镁离子的金属内固定物通过降钙素基因相关肽改善大鼠骨折愈合
2016-09-12 我要说
导语
2016年8月29日,国际学术权威刊物自然出版集团旗下子刊《Nature Medicine》杂志在线发表了香港中文大学秦岭教授团队和内地及国际合作者共同发表的关于创新型含镁金属骨折固定促进成骨作用机制及骨折修复作用的原创研究文章。共同第一作者是香港中文大学医学院骨科博士生张翼峰和许建坤博士、香港中文大学医学院基础医学院阮晔纯助理教授通讯作者为香港中文大学秦岭教授和北京大学郑玉峰教授。
可降解镁金属内固定物对治疗骨折有一定的疗效;然而,这一类内固定物在改善骨折愈合方面的潜在作用机制仍不甚明了。在此,香港中文大学秦岭教授团队和内地及国际合作者发现了含有超纯镁的髓内钉固定物植入到大鼠的股骨远端(非骨折模型)之后在周围皮质处产生了大量的新鲜骨情况。这一反应伴随着神经元降钙素基因相关多肽-a(CGRP)在股骨周围皮质和同侧背根神经节(DRG)两个部位的实质性增加。
他们观察到在该类模型中,采用手术切除骨膜、辣椒素注射去除感觉神经功能或是敲除CGRP受体的元件均可以从根本上削弱镁诱导的骨生成。然而,过度表达CGRP受体则明显强化镁诱导性的骨生成作用。体外实验,进一步发现细胞外镁离子的浓度增加会导致镁转运体1(MAGT1)-依赖体和短暂受体潜在阳离子通道,M亚族、成员7 (TRPM7)-依赖体的镁内流,以及细胞内三磷酸腺苷(ATP)增加。这些反应导致了DRG的末梢出现突触囊泡聚集现象。在分离的大鼠骨膜干细胞中,CGRP导致了CALCRL-和RAMP1-依赖性的CREB1和SP7(也称Osterix)的活化,因此强化了这些干细胞的成骨分化。更重要的是,研发了一种新型的载镁髓内钉并成功用于促进骨质疏松大鼠(卵巢切除术后)的股骨干骨折愈合。总而言之,从内固定物中释放出来的镁离子在促进CGRP为媒介的成骨分化方面发挥了显著的作用,解答了数十年来对镁基内固定物调节成骨机制的未解难题,提示镁离子在骨科领域具有潜在的治疗作用。
创伤、运动和年龄相关的肌肉骨骼损伤发病率在近年迅猛增加,加重了医疗和社会经济负担。临床常规应用的内固定物为永久性的坚硬金属(如不锈钢或金属钛制品),它们承担了正常作用于骨质的机械应力,即为人们所熟知的“应力屏障”,这一屏障减弱了进行负荷刺激之后的骨重塑,造成了渐进性的骨丢失,所以它也就一定程度上阻碍了骨折的愈合。生物降解性金属能够在骨折愈合期间逐渐被腐蚀,其所释放出的降解产物对骨愈合进程十分有益,而这正是临床所期盼的骨科植入体应用模式。另外,患者有望免受植入体摘除的手术及其相关的并发症(比如再次骨折和感染等)。
镁是维持骨骼健康的关键性基本元素,人体内60%的镁存储于骨基质内。镁缺失将导致骨质疏松,对骨质疏松患者补充镁十分有益。由于镁具有与自然骨骼相类似的生物力学特性,以及相比陶瓷生物材料更大的硬度,所以临床考虑将镁作为一种潜在的、生物可降解型骨科内固定物,用其对骨折处进行固定。然而,纯镁会在活体内迅速降解,无法对骨折愈合处提供长时间的力学支撑作用。秦岭教授和其它研究团队已经研发出了以金属镁做基质的合金或是大块金属玻璃(BMGs),这些材料已经表现出了在骨折愈合期间促进成骨的效应。这些合金或BMGs,由镁、钙、锌和锶等元素组成,具有良好的耐腐蚀性。该研究使用超纯镁材料来制备内固定材料并研究其在促进成骨方面所发挥的作用,以及其潜在的分子生物学机制。
在长骨管状骨中,骨膜是覆盖在骨皮质表面的一层结缔组织膜,其内包含了大量的骨膜干细胞(PDSCs),这些干细胞一直在骨的完整性、骨的塑形及重塑,尤其是在骨折的修复过程中发挥着重要作用。此外,骨膜内还密布着大量的感觉神经,据悉其释放的神经多肽也参与了骨的生成。其中,CGRP为最重要的骨合成代谢肽。有趣的是,研究团队先前所做的研究已经表明以镁合金或其BMGs植入物,在其被植入动物的股骨远端内之后增加了皮质骨的厚度,以周围皮质与骨膜的连接处的新骨形成尤为明显。所以,可推测镁离子可能从髓内植入物中释放到了骨膜内,而骨膜内的PDSCs和感觉神经极有可能在镁离子诱导的成骨过程中发挥了重要的作用。
为了满足在长骨骨折中的持续有效的力学固定的要求和充分利用镁离子的促成骨作用,研究团队还研制了一种新型的载镁髓内钉(Mg-IMN)并研究其在大鼠(卵巢切除诱导的骨质疏松模型)骨折愈合过程中所产生的作用。
一、骨膜在镁诱导的成骨反应中的作用
使用非骨折性的股骨模型来证实镁的成骨作用:将99.99%的纯镁棒平行植入到实验组大鼠一侧完整的股骨骨髓腔,而将不锈钢钢棒植入到对照组大鼠同样的部位。在术后2周时,对这些大鼠进行μX-线荧光(补充图1a–d)和扫描电子元素分析(补充图1e–h),结果均表明实验组模型在皮质骨和骨膜连接处的镁浓度明显高于对照组,提示了植入物释放出来的镁离子可以弥散分布到周围的组织中。同时,苏木素-伊红染色和钙黄绿素示踪结果也表明镁棒植入组的新骨主要集中在外周的皮质骨与骨膜移行处,然而,对照组中并未能观察到类似的成骨现象(见图1a)。小动物CT检查证实了在镁植入组大鼠股骨内的总骨量 (TV),高密度骨量(BV)以及模拟测试的力学性能均显著高于对照组(见图 1b,c)。
为了评估骨膜在镁诱导型新骨形成中的作用,在手术植入镁棒时手术清除了植入部位的骨膜。X线检查和小动物CT检查一致表明:在成功去除骨膜的部位没有新骨形成,只在含有残留骨膜的周围皮质骨部位有新骨生成,(见图1b,c和补充图2a)。
二、CGRP参与了镁诱导性成骨
为了测试骨膜内感觉神经在镁诱导性成骨中可能发挥的作用,采用文献已报道的方案,即通过注射大剂量的辣椒素进入到大鼠椎旁皮下,消除其感觉神经功能, 从而导致镁诱导的新骨形成活动在接受辣椒素治疗的大鼠组明显低于不接受辣椒素治疗组的大鼠(见图 1d,e)。有趣的是,将氯化镁溶液(100 μl/次, 10 mM,一次每天,连续3天) 注射到L3–L5椎间隙,也会导致同侧股骨的周围皮质骨处有新骨形成(见补充图2b)。术后2周,对镁植入后的股骨切片进行免疫荧光染色,结果表明在周围骨皮质处有丰富的CGRP,而在对照组,只发现了散在的CGRP(见图1f)。ELISA分析显示,对大鼠股骨远端植入镁棒后,骨组织内的CGRP浓度明显增高,在术后4天时浓度达到峰值,要比对照组高8倍,在术后7天和14天时,与术后4天时的情况相比浓度相对较低,但是此时的浓度值仍高于对照组的2倍(见图1f)。此外,在术后2周时,与对照组大鼠相比,镁植入后的大鼠在植入侧L4 DRGs处的CGRP仍然处于较高的表达状态(见图1g)。
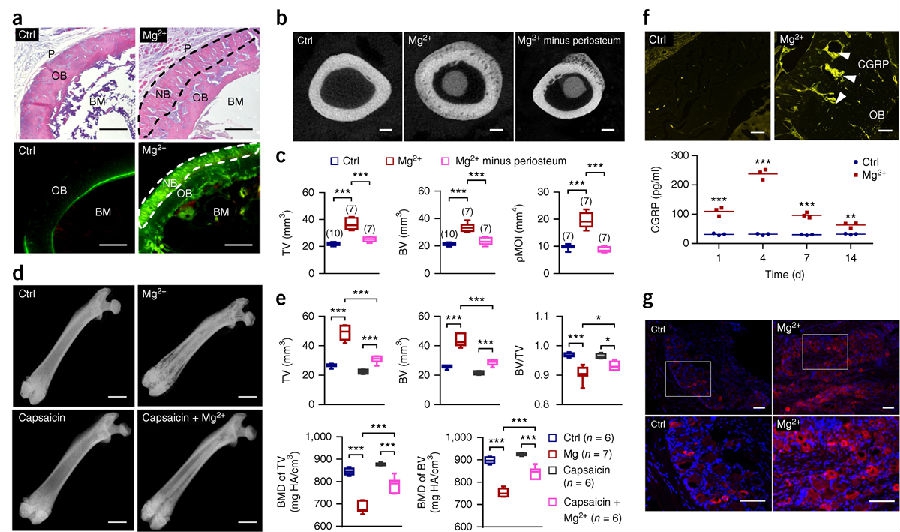
图1a-g

补充图a-h
研究人员还检测了其它感觉神经多肽的浓度,包括P物质、神经激肽和甘丙肽(文献报告中这些物质对骨愈合也产生了有益的作用)。ELISA分析表明P物质的浓度在镁植入术后4天时要比术前高出近1倍,而神经激肽K和甘丙肽在对大鼠植入镁植入之后与对照组相比没有显著不同(见补充图2c)。这些结果提示CGRP可能是镁诱导成骨过程中上调的主要神经多肽。为了进一步验证这一假说,研究团队将CGRP受体拮抗剂BIBN4096BS (BIBN, 100 μl,750 μg/ml,隔日注射)注入到与镁植入侧大鼠股骨处,与非BIBN治疗组相比,接受BIBN注射组的TV和 BV值在镁植入股骨中显著降低(见补充图2d–f)。
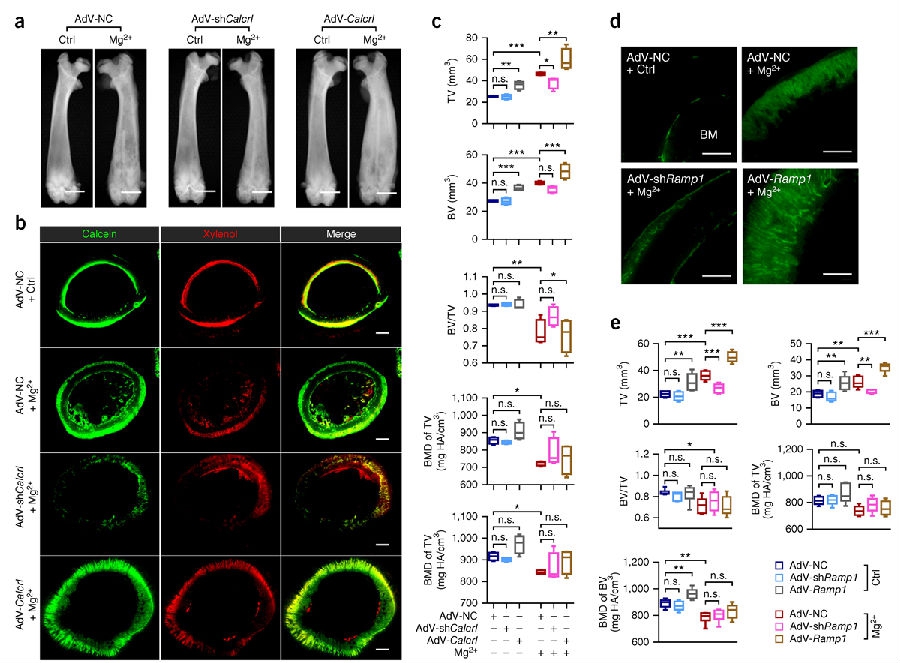
图2a-e

补充图2a-f
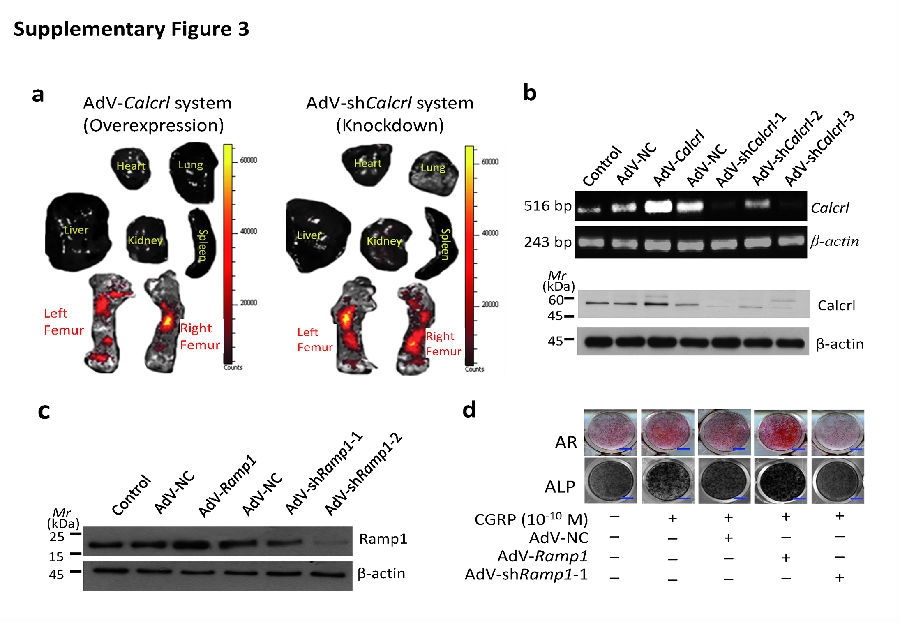
为了进一步证实CGRP参与其中,并且明确它的受体在镁诱导成骨过程中的作用,研究人员在大鼠活体模型的股骨注射腺病毒包装后的相关质粒来过表达或敲减降钙素类受体样受体(Calcrl)或受体活性修饰蛋白1 (Ramp1,CGRP的结合部位)(见补充图3)。活体荧光成像系统显示带有Calcrl (AdV-Calcrl)的腺病毒转染试剂或是靶向Calcrl的shRNA (AdV-shCalcrl)均位于股骨的注射部位处,伴有对侧股骨的小量弥散,但是在大鼠的主要代谢器官没有检测到这些物质(见补充图3a)。PCR和蛋白免疫印迹试验证实在大鼠股骨的Calcrl或Ramp1成功地被过度表达或敲减(见补充图3b,c)。通过影像学(见图2a)和钙黄绿素标记(见图2b)所示,Calcrl过表达进一步强化了镁诱导的新骨形成,然而Calcrl敲减之后,镁的这一作用被显著地抑制。根据小动物CT的分析结果,与接受阴性对照组(AdV-NC)的镁植入股骨相比,Calcrl的过度表达在试验组大鼠的镁植入连接处TV和BV显著增加,BV/TV或骨密度(BMD)没有差异(见图2c)。相反,在使用AdV-shCalcrl预处理和镁植入的大鼠组与股骨镁植入联合AdV-NC治疗组的大鼠组相比,TV显著降低(见图2c)。同时,研究人员观察到Ramp1-过度表达之后,镁植入股骨的TV和BV显著增高。相反地,Ramp1敲减之后,与AdV-NC预处理的股骨相比,同样接受了镁植入的标本中钙黄绿素标记区域明显减少,TV和BV浓度也较低(见图2d,e)。
据文献曾报道,CGRP包裹于神经突触的囊泡内并在DRG神经元轴突终端处释放。所以,研究人员检测了镁对来自于大鼠体内分离出的DRG神经元突触囊泡聚集情况所产生的效应(见图3a)。免疫荧光标示显示出在分离的DRG神经元内CGRP的表达(见图3b)。对位于DRG神经元内的突触囊泡使用FM1-43进行荧光染色标记并使用活体细胞共焦系统进行监测。在缺少镁离子(Mg2+)的培养环境下,FM1-43所标示的囊泡主要位于神经元的胞体内。往培养环境中增加氯化镁MgCl2 (1 mM)之后,5分钟之内FM1-43在神经元终端处发生聚集。随之而来,将另一个1 mM MgCl2添加到培养液中,即累计添加2 mM MgCl2,它会诱导神经元终端FM1-43的浓度进一步增加(见图3c和补充视频1),由此提示Mg2+诱导了囊泡向神经末梢运动和聚集。因为N-甲基-d- glucamin (NMDG)是一种细胞粘膜非渗透性的阳离子,所以研究团队将NMDG-Cl加入其内进行对照研究,NMDG-Cl对神经元终端的FM1-43强度不会产生明显的诱导效应,进而排除Cl-参与了这一进程(见补充图4a)。此外,Zn2+和 Mn2+,两个与Mg2+相似的二价阳离子,它们抑制而不是促进了FM1-43标示的囊泡聚集(见补充图4b,c)。此外,团队还发现Mg2+对囊泡的聚集效应在预先采用细胞松驰素B(抑制肌动蛋白的聚集)的细胞中不复出现(见图3d)。此外,在采用Mg2+对分离出的DRG神经元治疗之后,细胞内的ATP浓度升高(见图3e)。所以,这些结果提示Mg2+可能通过强化ATP加速肌动蛋白聚合的方式,促进了突触囊泡的聚集。
为了检测Mg2+是否能够进入到DRG神经元内,研究团队使用Mg2+敏感度染色剂Mg-Fura2来监测DRG神经元内的Mg2+细胞内浓度([Mg2+]i)变化情况。结果显示加入的MgCl2(10 mM)导致 [Mg2+]i的显著增加,证明了Mg2+进入到DRG神经元内。文献报告TRPM6, TRPM7 和 MAGT1可以携带Mg2+跨越细胞膜,所以研究团队还分别检测了它们的阻断剂效应(见图3f)。结果表明通过异环磷酰胺(50 μM, 抑制 MAGT1)或是2-氨乙氧基二苯酯硼酸(2-APB) (100 μM, 抑制TRPM7)的应用,明显抑制了Mg2+的进入,但是钌红没有这方面的作用(50 μM, 抑制TRPM6)。
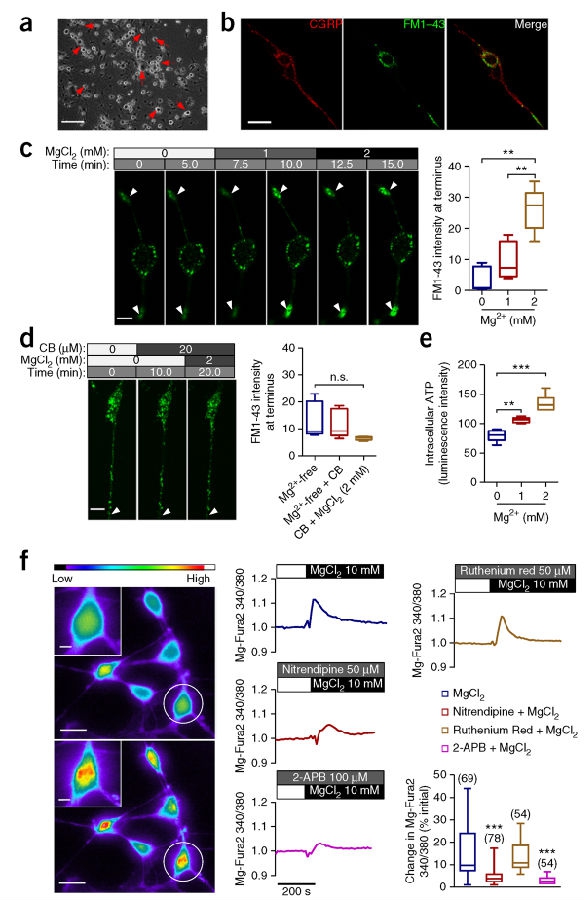
图3a-f
补充图3a-3d
三、CGRP促进PDSCs的成骨分化
在镁植入的股骨标本中,研究团队探测到在骨膜和新生骨组织之间有大量的细胞(见图4a),推测这些细胞为PDSCs。从大鼠的股骨骨膜处分离出这些细胞并确认了它们的细胞膜表面表达了干细胞相关的标志物(见补充图5)。在与不锈钢植入股骨(作为对照组)或无植入物的股骨(作为盲评对照)的PDSCs进行比较时,与活体内的结果检测相一致,碱性磷酸酶(ALP)和细胞茜素红(AR)染色结果表明从镁植入的股骨中分离出来的PDSCs具有更大的成骨分化能力(见图4b)。为了验证CGRP在镁诱导型成骨方面的媒介作用,检测了CGRP对PDSCs所产生的影响。研究团队首先观察到通过CGRP (高达 10−8 M)作用的PDSCs没有影响PDSCs的增殖(见图4c)。接着诱导了存在CGRP情况下的PDSCs成骨分化。实时PCR结果表明使用CGRP(10−12–10−8 M)治疗2星期的PDSCs明显促进了成骨标志物Alp, Bglap 和 Opn以浓度依赖方式进行的转录(见图4d)。正如ALP和 AR所示,CGRP诱导PDSCs成骨分化的作用在Calcrl或 Ramp1过度时得到了进一步促进,相反地,在它们敲减之后被明显地消减了(见图4e和图3d)。
CGRP受体的激活以环磷酸腺苷(cAMP)作为起始点,它可以造成转录因子(CREB1等)发生磷酸化,随之激活Sp7。蛋白质印迹结果表明通过使用CGRP(10−10M, 72小时)的治疗,与未采用CGRP治疗的大鼠相比,在PDSCs内产生了CREB1 和SP7磷酸化浓度升高的结果。然而,Calcrl敲减之后,CGRP的这些效应均被明显地削弱(见图4f)。本研究发现RUNX2的表达并没有受CGRP影响(见图4f)。
在体外实验中,研究团队还检测了来自于DRG神经元进行条件性培养基培养对PDSCs所产生的成骨分化作用。如ALP 和 AR染色所示,与接受对照培养基(无添加MgCl2的条件性培养基)的细胞相比,实验组PDSCs的成骨分化效率明显提高。并且,Mg2+处理后的条件性培养基并不能促进接受了Calcrl敲减的PDSCs的成骨分化(见图4g)。
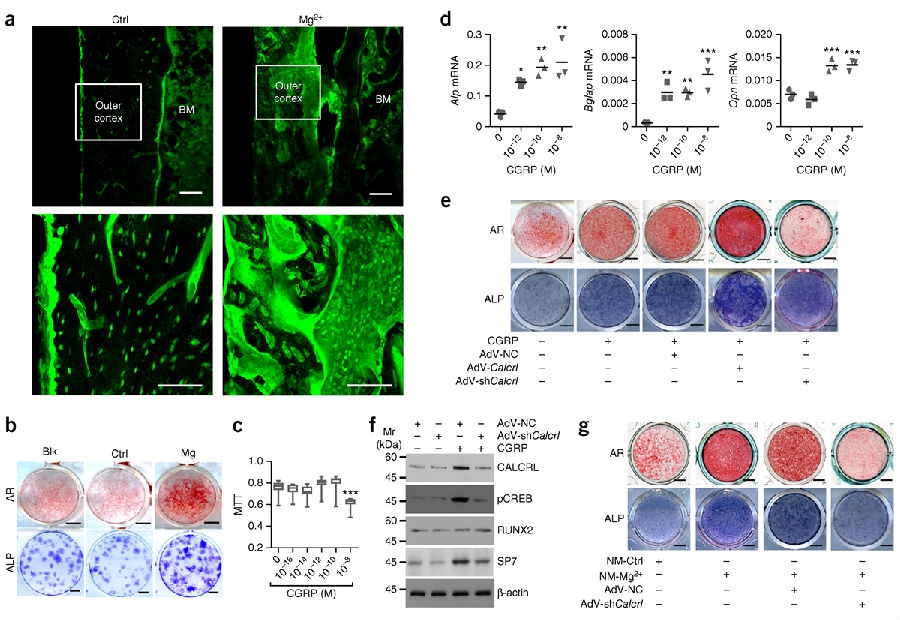
图4a-g
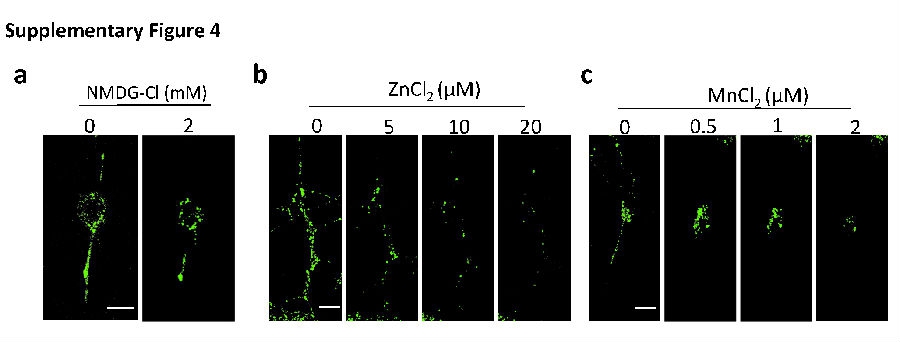
补充图4a-c
补充图5
四、Mg-IMN促进了骨折愈合
尽管观察到了成骨效应,但是在对大鼠植入纯镁棒3周后没能对长骨骨折处起到固定(见图6a)作用,研究团队认为这是由于随着时间推移镁棒发生了降解,削弱了其自身的力学强度,从而发生断裂。为了研究骨科应用领域金属镁的成骨效应,有机团队研制了带有“生物活性”的Mg-IMN,通过将镁棒插入到不锈钢制成的空心髓内针(中部有开窗,作为镁离子释放的通道)扬长避短地让镁金属发挥作用(见图6b,c)。有限元分析结果提示我们设计的Mg-IMN的力学强度与没有钻孔的IMN相匹配(见图6d)。
接着通过测试了Mg-IMN系统在治疗卵巢切除诱导的骨质疏松大鼠股骨骨折中所发挥的作用,与不含镁的IMN植入组进行了比较。在已知镁对成骨所产生的有益作用,而且骨膜也参与了镁诱导性成骨的情况下,研究团队进一步使用了闭合性的股骨骨折模型,这些模型在骨损伤过程中一直保持了骨膜的完整。来自于Mg-IMN系统进入到骨组织和骨膜内所产生的镁弥散效应(见补充图6e),与在完整股骨内使用纯镁棒的情况相类似(见图1)。X线分析显示在植入手术后4周时,Mg-IMN植入组大鼠的骨痂宽度和面积显著大于IMN组,但是在术后6周、8周或12周时没有发现两组间的差异(见图5a,b)。小动物CT结果显示与IMN组大鼠相比,在Mg-IMN组大鼠TV和BV较多,但是BV/TV值较低(见图5c和补充图7a)。在骨折愈合后期,Mg-IMN组大鼠的TV值降低,与IMN组大鼠相比没有差异(见图5c)。然而,与对照组相比,Mg-IMN组的BV值在植入手术后8周时仍然保持在较高水平,但是到12周时,两组之间的BV值没有差异(见图5c)。Mg-IMN组大鼠与IMN组大鼠相比,在术后4周时TV内的BMD值较低,但是在12周时则增高(见图5c)。这些结果提示在骨折愈合早期有更多的骨痂组织形成,与IMN组相比,Mg-IMN组大鼠在手术后期的骨矿化过程加快。更为重要的是,在术后12周时,四点弯曲生物力学测试表明Mg-IMN组股骨干最大挤压负荷要显著高于IMN组(见图5d)。
组织形态学分析提示骨折的愈合方式为典型的继发性骨折愈合,即伴有骨痂形成、膜内骨化和软骨内骨化(见图5e,f和补充图7b)。与IMN组大鼠相比,Mg-IMN组大鼠在术后2周时可见更多的骨膜内成骨、伴有骨痂内的CGRP表达增加,在术后4周时有更多的软骨内成骨(见图5e,f和补充图7c)。从8周到12周,编织骨和软骨内组织逐渐被层状结构桥接到骨折空隙处(见补充图7b)。偏振光图像显示,在术后4周时,Mg-IMN组大鼠与IMN组大鼠相比,骨痂内的胶原纤维排列得更好(见图5f)。
在Mg-IMN组大鼠要比IMN组大鼠内有更多的光亮纤维和规则层状骨,所以在Mg-IMN组展现出了更强的力学特性。进一步的钙黄绿素标记提示,Mg-IMN组大鼠与IMN组大鼠相比,从术后4-8周新骨形成速度加快(见图5g,h)。在12周时,Mg-IMN组钙黄绿素比率染色显著低于IMN组大鼠,提示有成熟的层状骨组织形成(见图5g,h)。与体外试验的结果相一致,在2周时,Mg-IMN组大鼠要比IMN组大鼠在骨折骨痂内的SP7表达出现实质性的增高,然而两组之间的RUNX2表达没有差异(见补充图7d)。此外,术后2周时,对增殖标志物Ki67和成骨细胞标志物RUNX2进行双重染色,Mg-IMN组要比IMN组在骨折骨痂内的Ki67和RUNX2双阳性的细胞数量显著增加(P < 0.001)(见补充图7e)。与此相一致,相比对照组的治疗,在位于培养基内的成骨细胞线的MC3T3-E1细胞,CGRP的增加(10−10 M)促进了更多的细胞增殖(见补充图7f)。这种强化性的成骨细胞增殖可能解释了Mg-IMN植入股骨骨折愈合的早期导致较大的骨痂形成(见图5a,b)。
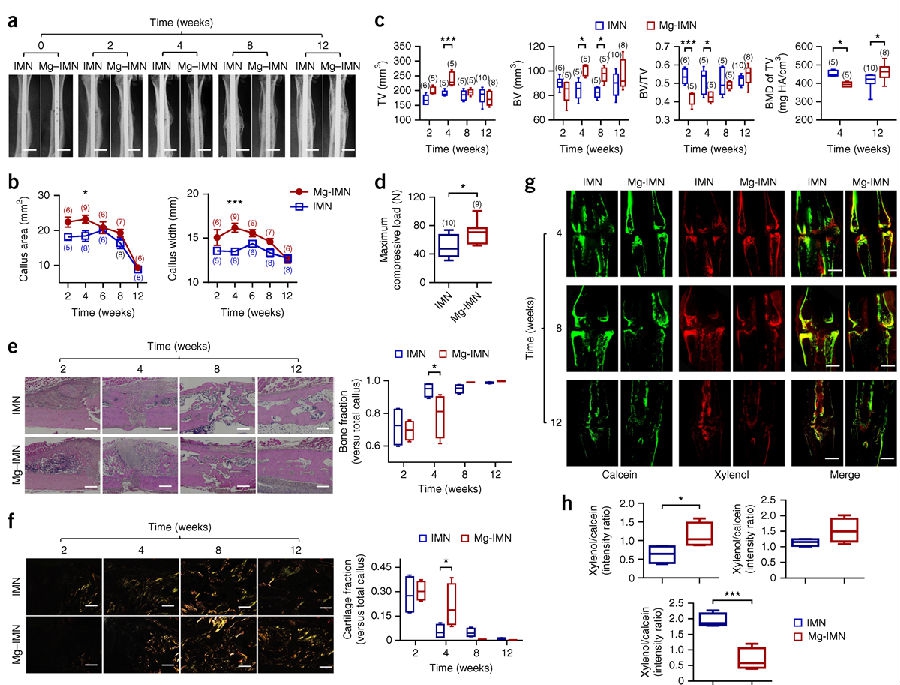
图5a-h
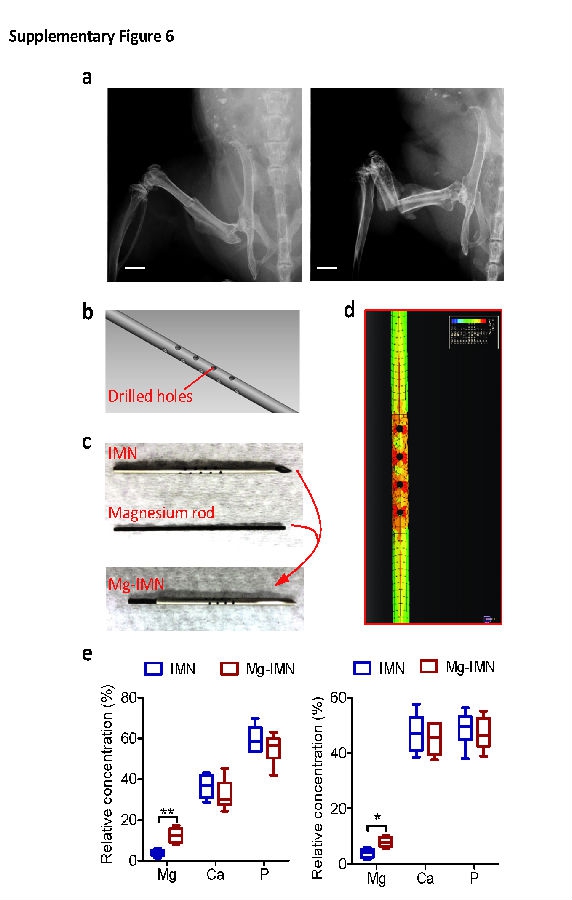
补充图6
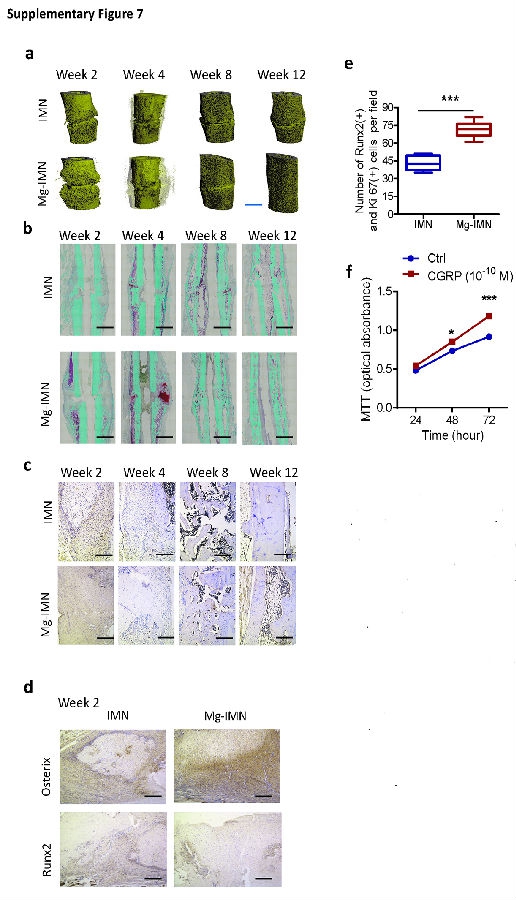
补充图7
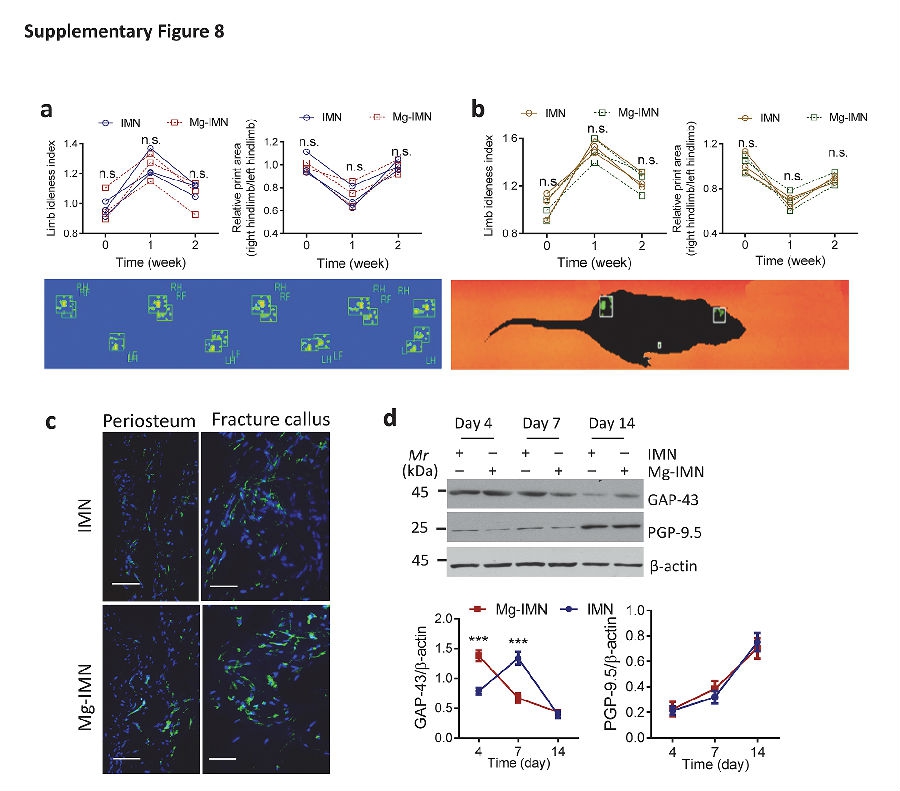
补充图8
CGRP感觉神经与疼痛有关的情况下。 研究团队通过自动化步态分析系统来监测大鼠步态态改变,以此评估大鼠的疼痛程度。在IMN和Mg-IMN两组大鼠中,与术前状态相比,它们的肢体惰性指数(LII)评分增加,而植入侧足底着地面积于植入手术后1周时降低,提示有疼痛存在(见补充图8)。然而,在术后1周和2周时,Mg-IMN 和IMN组大鼠之间, LII和足底着地面积均没有统计学差异(见补充图8a,b),提示它们承受着同等水平的疼痛程度,即使在术后4天,Mg-IMN 大鼠组比IMN组大鼠CGRP表达相当高的情况下也是如此(见补充图8c)。因为神经纤维的异常出芽生长也能造成疼痛,所以研究团队还对术后1-14天的神经纤维生长情况进行了测试分析。生长相关蛋白43(新生神经的标志物)的表达虽然在术后4天时Mg-IMN组要比IMN组显著增高,但是在术后7天时却显著降低(P < 0.001)(见补充图8d)。从术后4天至14天时,蛋白基因产物9.5(成熟神经的标志物)在两组大鼠之间没有差别(见补充图8d)。
五、CGRP受体在Mg-IMN促进骨折愈合的作用
为了确认CGRP和其受体在Mg-IMN加速骨折愈合中的作用,研究团队进行了活体内的Ramp1敲减和过表达,检测它们与Mg-IMN植入物促进成骨的关系。影像学(见图6a)和番红染色(见图6b)表现出Mg-IMN加快了骨折愈合,与空白载体组相比,Ramp1过表达之后镁的促成骨作用得到了强化,相反,Ramp1敲减很大程度上削弱了镁的作用。此外,在Ramp1敲减的模型中发现了异常多的纤维组织填充到了股骨的骨折空隙处(见图6b)。
通过四点弯曲生物力学测试,确定不同治疗组大鼠骨修复后的力学性能。术后4周,AdV-shRamp1预处理的大鼠即便接受了Mg-IMN 植入,与那些接受了AdV-NC预处理的大鼠相比,最大挤压负荷显著降低(见图6c)。相反,在AdV-Ramp1治疗的股骨中则较高(见图6c)。
六、讨论
人体和它动物的研究提示以镁为主的合金或其BMGs在骨形成方面有促进作用,然而尚未有对这方面益处的潜在机制的研究。秦岭教授团队根据体外和活体内的发现提供了这方面的强有力证据,对镁在促进骨形成和骨折愈合方面的强化作用及其根本机制进行了论述。镁的益处在很大程度上是由来自于长骨干骨膜内由感觉神经元末梢释放的神经多肽物质(以CGRP为主)来调节的。虽然临床长期以来一直认为中枢神经系统在调节骨形成方面发挥了重要作用,但是感觉神经在这一过程中所发挥的确切作用仍未有共识。本研究首次确定了CGRP介导的感觉神经与PDSCs的交联在作为镁诱导的新骨形成的主要机制(见图6d)。
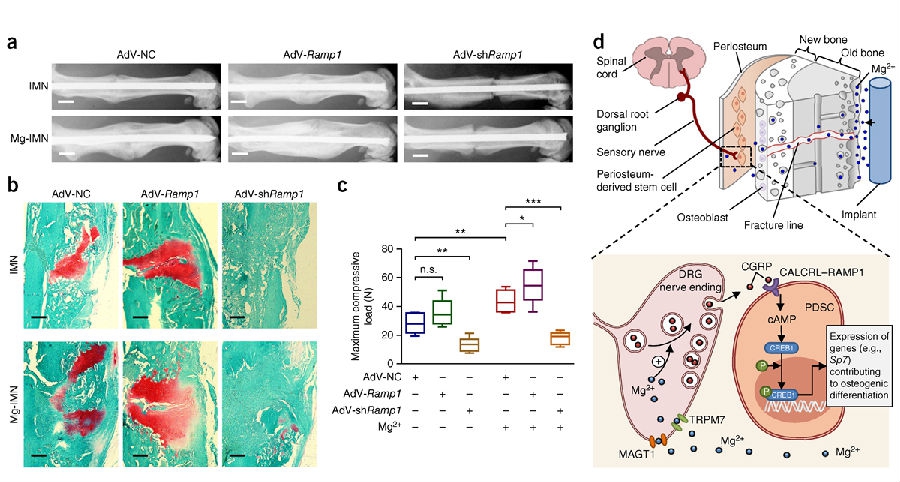
图6a-d
本项研究的几点发现都能提示了感觉神经分泌的CGRP参与了镁的促骨形成效应。首先,通过摧毁感觉神经或骨膜切除的方式,都能极大降低了镁诱导的骨形成作用。第二,在新形成的骨组织内,镁刺激神经元分泌更多的CGRP。关于DRG神经元培养的研究提示Mg2+对CGRP的效应是通过如下两种方式来实现的:(i) MAGT1-和TRPM7调节的Mg2+进入神经元胞体内;(ii) Mg2+很有可能是通过促进肌动蛋白聚合而加速CGRP阳性的囊泡在突触处聚集。更有说服力的证据是:在活体内CGRP受体的药物抑制或与其相关基因(Calcrl 或 Ramp1)的静默减弱了由镁植入物(镁棒或Mg-IMN)所产生的新骨形成作用,而活体内Calcrl 或Ramp1的过度表达则强化了镁植入体的有益效应。值得注意的是,CALCRL除了能与RAMP1构成CGRP受体,它还能够与RAMP2共同表达,以此形成amylin受体,该受体可抑制骨吸收。然而,Calcrl 或是Ramp1的基因干扰结果表明,它们对镁诱导性骨形成的影响效果是接近的,由此进一步提示的确是CGRP,而并非amylin调控了镁诱导的新骨形成。
另外,在分离出的PDSCs(参与镁诱导的新骨形成的关键细胞类型)中,CGRP通过CGRP受体配对的CREB1和SP7(CREB1 和 SP7是骨形成的必要转录因子)激活促进了成骨分化。值得注意的是在体外和活体内的研究结果提示CGRP或镁植入物只能上调SP7,但是不能上调RUNX2(另一个处于CREB1下游的转录因子,对成骨也有着重要作用),由此提示CREB1 和 SP7的特殊激活促进了PDSCs的成骨分化(见图6d)。然而,尚需开展进一步的研究来了解RUNX2为何没对镁或CGRP产生反应,以及其它文献所报告的CREB1-调节通道(例如,BMP2,Wnt/β-连环蛋白)是否也参与了这一过程。
前人相关的的研究发现:成年动物骨折延迟愈合时常伴有CGRP不足及骨基质内镁丢失。也有为数不多的研究发现了CGRP促进骨痂形成和骨重塑,而缺乏CGRP+神经纤维则会导致骨折延迟愈合或不愈合。在此基础之上,本研究确认了镁离子会促进CGRP表达,从而增加骨生成,由此提示其在骨质疏松性骨折或其它骨病方面的治疗功效。不过,镁植入物或是CGRP如何影响其它类型的细胞(比如软骨细胞)还有待进行深入调研。另一方面,测试镁的系统用药疗效(比如口服镁剂)也显得十分重要,需要重点地验证其能否促进CGRP的表达,从而明确镁离子是否可以作为治疗骨病的潜在营养因子。
本研究所取得的另一大进展在于Mg-IMN系统的研发并成功应用该系统其用于修复长骨骨折,在力学支撑和促骨生成两方面两个方面都体现优势。众所周知,骨质疏松患者常发生闭合性骨折,也就是临床俗称的低能量型骨折。作为概念验证性的试验,团队使用了可完整保留骨膜的较闭合性骨折的模型。此外,植入伴有邻近骨折线处钻孔的Mg-IMN,确保释放出的大部分Mg2+能够进入到伤口部位。正如所期望的,通过检测我们发现在Mg-IMN大鼠组骨折骨痂周围镁的含量高于IMN组。因为Mg2+的直径(<300 pm)要比骨组织内的Harversian’s 或 Volkmann’s通道直径小,所以释放出的镁离子可以顺利地被转运到了骨膜区域(在微观层面)。此外,Mg2+还可以通过骨折线进行弥散(见图6d)。
采用Mg-IMN治疗大鼠骨质疏松性骨折的疗效甚是鼓舞人心的。首先,Mg-IMN加速了骨的重塑,在治疗初期(4周时)骨痂增加明显,而后期时Mg-IMN的骨痂塑形更快。第二,通过Mg-IMN的使用,改善了愈合后的骨组织的生物力学性能。在研究的终点时(第12周)Mg-IMN组钙黄绿素染色的比率低于IMN组,大概是由于骨的重塑完成所致,但是采用Mg-IMN治疗的大鼠,其BMD较高,骨折处出现了更好的层状骨形态,此种情况提示该组大鼠要比IMN治疗组大鼠有更好的力学强度。这一结果也与先前文献中报道的Mg2+处理的细胞外基质胶原基质排列更好的结果相一致。值得注意的是,在本研究中,新骨g生成主要是在骨膜区,即便是BV只有较少的增加也足以引起,生物力学特性(即弯曲力或是抗扭力强度)发生实质性改变,先前的文献也有过这方面的报道。的确,生物力学测试中也证实了Mg-IMN治疗组的骨力学特性要比对照组更强。并且,也发现使用Mg-IMN组大鼠的疼痛水平与对照组有差别,提示Mg-IMN适合骨科临床应用。
简而言之,秦岭教授团队的研究明确了CGRP参与的促骨折愈合机制在镁植入物的促成骨效应中的作用, 并研发了新型的Mg-IMN系统并证明其对骨折愈合有显著的促进作用,至少体现在它对常见的低能量骨质疏松性骨折是有效的。受益于日趋成熟的递质系统如对特定类型的细胞或组织的靶向技术,通过对特定的区域递送Mg2+或重组型的CGRP来增加骨量或促进骨折愈合。总之,这些新的发现有望进一步拓宽镁及其合金治疗或预防其它骨病或损伤,比如运动损伤或其它创伤所致的高能量骨折。
附:具体内容请以自然医学发表的英文原稿为准,点击链接查看原文:http://www.nature.com/nm/journal/vaop/ncurrent/full/nm.4162.html
作者简介

秦岭, 香港中文大学医学院骨科教授和实验室主任, 博士及博士后导师。1982年毕业于北京体育大学人体生命运动科学学院;1992年获得德国科隆体育大学运动科学博士学位;1992年在瑞士国际骨折内固定研究所(AO)完成骨质疏松博士后研究,1993年受聘于德国柏林自由大学医学院创伤和重建外科学系任实验室主管;1994年加入香港中文大学,任医学院矫形外科及创伤学系研究室主任。二十多年来,秦岭教授建立多学科跨领域合作团队,常见和多发的骨质疏松和骨坏死骨等骨科疾患的病因、病生理、诊断与防治方向从事基础和临床医学应用研究, 包括有自主知识产权的活性生物材料的研发和转化研究。
目前秦岭教授共申请专利8 项,获 30 多项国际/地区性奖项; 已发表9本专著、90多章节、包括Nature Medicine,Biomaterials, Acta Biomarialia, American Journal Sports Medicine、Journal of Bone and Mineral Research, Osteoporosis International 和Bone在内360篇学术论文(英、德、中三种杂志期刊),其中280篇SCI论文,被引近6000次, H-Index 44。分别担任10 个国际和国内学术组织职务,包括国际华人骨研学会主席(2009-2011)(www.icmrs.net)、 6个SCI杂志主编、副主编和编委,包括Journal of Orthopaedic Translation (主编) (http://ees.elsevier.com/jot)、Journal of Bone and Mineral Research (www.jbmr.org)和International Journal of Sports Medicine (编委) (http://www.thieme.de/sportsmed); 矫形外科与研究杂志和临床生物力学杂志副主编。除主持香港特区的科技研发项目外,还主持多项国家和国际合作重大科研项目:包括科技部十二五重大新药创制项目、国家自然科学基金委员会与欧盟科研与创新总司合作研究项目等。2013年获得香港中文大学首次设立的“医学院杰出学人”和入选美国医学与生物工程院(AIMBE Fellow: http://www.aimbe.org)和入选2016年首次设立的国际骨科研究联合会fellow (http://i-cors.org/events)





 京公网安备11010502051256号
京公网安备11010502051256号