新辅助化疗治疗肢体软组织肉瘤28例报告
2015-04-21 文章来源:济南军区总医院骨病科 王冰 于秀淳* 许宋锋 徐明 郑凯 刘江 我要说
软组织肉瘤(soft tissue sarcoma,STS)是指起源于胚胎中胚层间叶组织的恶性肿瘤。其年发病率约为2/100 000,并有逐年上升趋势,可发生于任何年龄和身体各个部位,分别占儿童和成人恶性肿瘤的15%和1%;其5年生存率约为50~60%[1-3]。目前治疗一般采用根治性的手术或联合辅助放疗,但总体治疗效果并不理想,大多数病人因发生远处转移而死亡,约10% 的患者在初诊时已发生转移,80% 在起病后2~3 年内发生转移[4]。而化疗是能够控制肿瘤远处转移的重要治疗手段,但是对于软组织肉瘤的化疗疗效,尤其是新辅助化疗的临床应用价值目前尚未有统一的认识。本研究通过总结我科自2009年5月至2012年6月应用新辅助化疗治疗28例肢体软组织肉瘤的临床疗效,以期评价新辅助化疗的应用价值。
资料与方法
一、一般资料
本组28例,其中男18例,女10例;年龄15~62岁,平均39.5岁,中位年龄35岁;恶性纤维组织细胞瘤12例,滑膜肉瘤4例,平滑肌肉瘤3例,横纹肌肉瘤4例,上皮样肉瘤2例,原始神经外胚层瘤3例;肿瘤发生于大腿8例,小腿5例,臀部4例,肩部4例,前臂3例,腋窝2例,腘窝2例;肿瘤原发18例,复发10例;最大直径8~30cm,平均15cm(表1)。
二、治疗方法
所有患者入院后行病变部位增强CT和/或MRI检查,确定肿瘤部位、大小及范围。原发患者通过穿刺活检方式明确病理诊断;复发患者原病理切片经本院病理科会诊后得到病理结果。
明确诊断后,按顺铂(cisplatin,DDP)+异环磷酰胺(ifosfamide,IFO)+阿霉素(adriamycin,ADM)(DIA)方案给予术前化疗(图1)。全部药物均经静脉给药,用药顺序:第1天给予DDP,第7-9天同时按序给予ADM+IFO,第10-11天继续给予IFO,为1个周期,间隔2周后给予术前第2周期化疗。1个周期内给药剂量:DDP为每日1次,每次120mg/m2,用1天/周期;IFO为每日1次,每次2.0g/m2,连用5天/周期;ADM为每日1次,每次30mg/m2,连用3天/周期。化疗期间应用止吐、保肝、解毒等药物对症治疗,化疗全程监测血常规、肝功及生化指标变化情况,当白细胞低于3.5×109/L时应用粒细胞刺激因子治疗。
2个化疗周期结束后复查增强CT和/或MRI检查,并评定化疗效果;休息2周后的进行手术治疗,其中行肿瘤扩大切除术25例,截肢术3例;切口按时换药,指导患者逐步恢复肢体功能锻炼,术后2周切口愈合拆线,行第3周期化疗,其中4例复发与3例肺转移患者辅助三维适行放疗,放射剂量40~60Gy不等;之后每间隔3周行DIA方案化疗,术后共化疗6个周期(图1)。
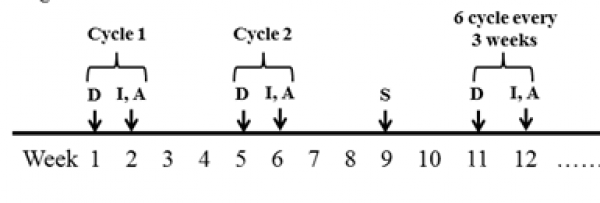
图 1 DIA化疗方案:D代表顺铂,I代表异环磷酰胺,A代表阿霉素,S代表手术
三、术后随访
术后半年内每个月随访一次,2年内每3个月随访一次,之后每半年随访一次,随访期间每隔3个月复查肺部CT及病变部位X线片,并记录复发、转移、死亡的时间。计算患者的2年无瘤生存率及生存率。
四、化疗毒性评价
依据美国国家癌症研究所(National Cancer Institute, NCI)的常见不良反应事件评价标准(Common Terminology Criteria for Adverse Events, CTCAE) (Version 4.0),记录和评价化疗过程中出现的主要不良反应[5]。该评价标准对每个不良事件的严重程度分为5级:1级,轻度,无症状或症状轻微,无须治疗;2级,中度,需要较小、局部或非侵入性治疗,引起日常活动轻度受限;3级,严重或者医学上有重要意义,但不会立即危及生命,会导致住院或者延长住院时间,甚至致残,个人日常生活明显受限;4级,危及生命,需要紧急治疗;5级,与不良事件相关的死亡。
五、化疗疗效评价
根据化疗前后病变部位影像学上的变化情况,按照欧洲肿瘤年会(European Cancer Conference,ECCO)提出的实体瘤疗效评价标准(Response Evaluation Criteria In Solid Tumour, RECIST) 1.1评价化疗疗效[6]。该标准分为完全缓解(complete remssion,CR)、部分缓解 (partial remission,PR)、稳定(stable disease,SD)、病变进展(progression diseas,PD)4种状态。其中CR为所有目标病灶完全消失;PR为影像资料测得的所有目标病灶最长径总和减少≥30%;PD为影像资料测得的所有病灶长径总和增加>20%,出现新病灶或最小径的绝对数值增大5 mm;SD为影像资料测得的所有病灶长径总和有缩小但未达PR或增加但未达PD。计算客观缓解率(Objective Response Rate,ORR),计算疾病控制率(Disease Control Rate,DCR) ,公式:ORR =(CR+PR)*100%/总例数;DCR=(CR+PR+SD)*100%/总例数。
六、统计学方法
采用SPSS19.0统计软件,应用Kaplan-Meier法计算患者的2年无瘤生存率及生存率。
表1 28例软组织肉瘤的临床资料
项目 | 病例数 | 百分比(%) |
性别 | ||
男性 | 18 | 64.3 |
女性 | 10 | 35.7 |
年龄 | ||
18~40岁 | 12 | 42.9 |
40~67岁 | 16 | 57.1 |
组织学 | ||
恶性纤维组织细胞瘤 | 12 | 42.9 |
滑膜肉瘤 | 4 | 12.3 |
平滑肌肉瘤 | 3 | 10.7 |
横纹肌肉瘤 | 4 | 12.3 |
上皮样肉瘤 | 2 | 7.1 |
原始神经外胚层瘤 | 3 | 10.7 |
部位 | ||
大腿 | 8 | 28.6 |
小腿 | 5 | 17.9 |
臀部 | 4 | 12.3 |
肩部 | 4 | 12.3 |
前臂 | 3 | 10.7 |
腋窝 | 2 | 7.1 |
腘窝 | 2 | 7.1 |
最大直径 | ||
8-15cm | 6 | 21.4 |
15-30cm | 22 | 78.6 |
入院是否原发 | ||
是 | 18 | 64.3 |
否 | 10 | 35.7 |
术后放疗 | ||
是 | 7 | 25 |
否 | 21 | 75 |
术后转移 | ||
是 | 5 | 15.9 |
否 | 23 | 84.1 |
术后复发 | ||
是 | 4 | 12.3 |
否 | 24 | 85.8 |
结 果
一、一般情况
DIA化疗方案包括术前2周期、术后6周期化疗,持续时间为38周。全部患者手术进行顺利,总失血量50-600ml(260ml±27.9),切口如期愈合,观察切口无红肿、渗出后开始术后化疗。28例患者共进行了224个化疗周期。28例随访12~59个月,中位随访时间32个月。生存时间24~59个月,其中无瘤生存20例,带瘤生存3例;死亡5例,均为肺部转移而死亡,其中上皮样肉瘤2例,恶性纤维组织细胞瘤3例,本组2年生存率82.1%,2年无瘤生存率71.4%(图2)。4例术后复发,其中1例上皮样肉瘤患者同时发现肺转移、死亡,2例恶性纤维组织细胞瘤、1例平滑肌肉瘤患者均再次行扩大切除手术治疗,并辅助放疗,目前随访无异常。
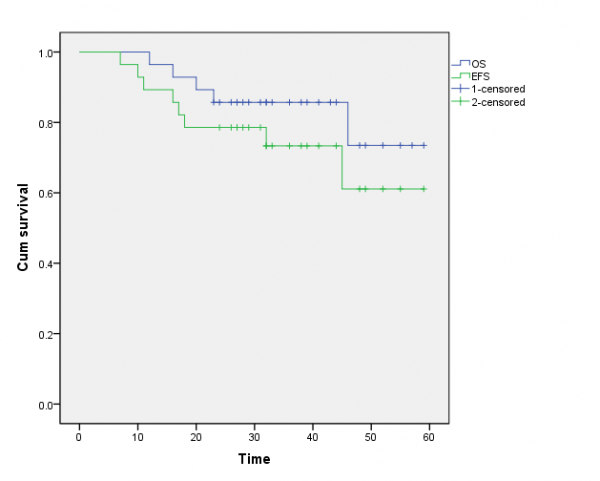
图2 28例2年生存率82.1%,2年无瘤生存率71.4%。
二、化疗毒性评价
在224个化疗周期中,主要不良反应事件为骨髓抑制、恶心呕吐、肝功异常、脱发等,均为一过性,经用药对症处理后症状消失,患者对化疗耐受性良好,依从性高(表2)。
表2化疗的主要不良反应 (NCI常见不良反应事件评价标准CTCAE, Version 4.0)
毒副反应指标 | 1级 | 2级 | 3级 | 4级 | 5级 | |||||
n | % | n | % | n | % | n | % | n | % | |
发热性中性粒细胞减少 |
| 1 | 3.57% | 3 | 17.86% |
|
| |||
呕吐 | 8 | 28.57% | 12 | 42.86% | 8 | 28.57% |
|
| ||
丙氨酸氨基转移酶增高 | 6 | 21.43% | 3 | 10.71% |
|
| — |
| ||
中性粒细胞计数降低 | 13 | 46.43% | 5 | 17.86% | 4 | 14.29% | 2 | 7.14% | — |
|
血小板计数降低 | 6 | 21.43% | 2 | 7.14% | 1 | 3.57% |
| — |
| |
脱发 | 9 | 32.14% | 19 | 67.86% | — |
| — |
| — |
|
三、化疗疗效评价
参照 ECCO实体瘤疗效评价标准(RECIST 1.1),28例中CR0例,PR12例,SD14例,PD2例,客观缓解率ORR为42.9%,疾病控制率DCR为92.9%。
典型病例
患者,女,15岁,因发现右前臂渐大肿物伴右手麻木活动受限1个月入院。查体:右前臂肿胀,右手爪形手畸形,右前臂可及大小约20×15cm质韧肿物,边界不清,压痛,不活动,未见浅表静脉曲张,局部皮温略高,皮色正常,腕横纹近端5cm处周径右侧24cm,左侧17cm,右手主、被动伸直活动受限,尺侧3个手指为重,右手五指掌侧感觉减退,Tinnel征阳性,右侧桡动脉搏动正常。MRI示:右前臂软组织肿胀,内见斑片状高信号影,增强后不均匀强化,增强后病灶边界较清,内可见血管影,周围肌群受压。入院后给予穿刺活检,病理提示横纹肌肉瘤。术前均按DIA方案化疗2个周期,顺铂120mg/m2 第1天,阿霉素30mg/m2 第7-9天,异环磷酰胺2g/m2第7-11天,同时给予止吐、保肝、升白、解毒等药物对症治疗。化疗后疼痛减轻,软组织肿物明显缩小,边界变清晰,大小约10×5cm,腕横纹近端5cm处周径右侧17.5cm,左侧17cm。排除手术禁忌后,于臂丛麻醉下行右前臂软组织肿瘤扩大切除、肌腱重建、肘后淋巴结切除术。术中见肿瘤组织位于指浅屈肌腱深层、桡动脉及桡神经内侧,包裹小指、无名指、中指浅屈肌腱,未侵及血管、神经,边缘尚清,包膜完整。自肿瘤边缘锐性游离连同指浅屈肌腱一并切除,切断的肌腱吻合于相应指深屈肌腱上。于肘关节后内侧、头静脉内侧分离出数枚肿大淋巴结,最大直径约1cm,一并予以清理切除。术后前臂石膏托固定制动约6周,给予消肿、活血、营养神经等药物对症治疗,指导患者上肢功能锻炼,切口按时换药,术后病理证实为横纹肌肉瘤,淋巴结无转移。2周后切口I期愈合,开始给予DIA方案化疗6个周期。现术后随访2年,右上肢功能恢复良好,无复发及转移(图3)。
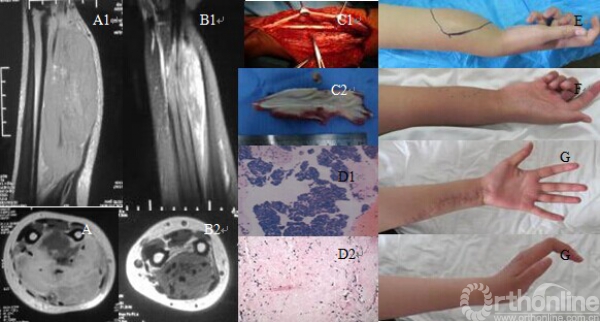
图3:患者,女,15岁。A1、A2,化疗前MRI:右前臂软组织肿块形成,边界不清,内见斑片状高信号影,内可见血管影,周围肌群受压;B1、B2,2周期术前化疗后MRI:右前臂肿块明显缩小约50%,边界清晰,横断位可见软组织肿块与骨质不相连;C1、C2,手术中发现肿物呈灰黄色鱼肉样组织,边界尚清,包裹指浅屈肌腱,并于肘后切除肿大淋巴结1枚;D1,化疗前穿刺病理示恶性肿瘤细胞巢(光镜 HE×200);D2,术后病理提示为横纹肌肉瘤,肿瘤细胞明显退变、坏死(光镜 HE×200);E,化疗前外观,掌横纹近端5cm处周径24cm;F,2周期化疗后外观,掌横纹近端5cm处周径17.5cm;G1、G2,术后2年随访外观,右手及腕关节功能恢复正常。
讨 论
STS是一种生长相对缓慢的恶性肿瘤,多无完整包膜,生长呈侵袭性,治疗多采用以根治性外科手术为主的综合治疗。我科自1993年起应用手术、放疗、化疗等综合方法对恶性软组织肿瘤进行保肢治疗,并取得了良好的临床疗效[7]。随着综合治疗原则的推广,患者的生存率、保肢率以及术后的生活质量有了明显的提高。一部分STS经过手术治疗后可能会出现局部复发,但是真正能够威胁到患者生命的是难以控制的微小转移灶或大范围的全身转移。对于存在远处转移的晚期STS患者,全身化疗可起到明确的疗效[7],但是对于早期原发的STS患者,化疗的应用价值仍存在争议。
STS的化疗是借鉴了其它实体肿瘤的化疗经验逐步发展的。早期有相关临床研究认为,化疗并没有改变软组织肉瘤患者的总生存率以及总复发率[9-10]。这与STS病理分型复杂多样、对于化疗药物的敏感程度各不相同、药物单一或联合应用方案不统一有关。Pervaiz等[11]对应用化疗的STS进行大样本的Meta分析,得出了化疗能降低局部复发率和远处转移率,同时化疗后的总生存率也有了显著改善。近年来,美国NCCN软组织肿瘤诊治要点强调辅助化疗,尤其是术前的新辅助化疗的作用。对于新辅助化疗的意义,尽管目前没有大样本随机对照研究,但术前化疗能够缩小手术切除范围,减少对肢体功能的影响,尤其对于切缘难以明确和高分级肉瘤,新辅助化疗的应用能够提高局部控制率,提高总生存率及无瘤生存率[12]。
新辅助化疗可作为高风险STS患者的治疗方式,如肿瘤分级高(G2-G3 )、范围广、位置深、直径大等[13],尤其对化疗敏感的横纹肌肉瘤、原始神经外胚层瘤 [14-15],其放疗、化疗、手术为主的综合治疗已被公认,化疗方案的选择也各不相同。Gortzak E等[16]研究表明,尽管新辅助化疗对于高风险患者的总生存率影响不大,但是可以减少患者的局部复发及远处转移的风险。新辅助化疗理论上比单纯术后辅助化疗更有优势:首先,通过术前化疗能够尽早明确个体对于化疗的敏感性,如术前化疗无效或疗效较差的患者则须及时更换化疗方案,以期达到更好的效果;其次,术前化疗可以尽早对微小转移灶进行治疗与控制,防止术后微小转移灶的进展;再次,术前化疗可以明显缩小肿瘤体积,减轻肿瘤周围的软组织水肿,有利于肢体软组织肉瘤的顺利切除。本组病例中,经过术前化疗,肿瘤体积平均缩小30%,其中一些难以彻底切除的巨大软组织肉瘤,如本组病例中22例肿瘤直径大于15cm的患者,通过术前化疗缩小肿瘤体积后,能够接受完整切除的手术,甚至能使需要截肢的患者接受保肢手术治疗,提高了保肢率。本组中1例原始神经外胚层瘤患者,术前右下肢巨大软组织肿块形成,自右股部后方延伸至右小腿后方,肿瘤体积巨大,边界不清晰,侵及范围广泛,在我科行2个周期DIA方案化疗后肿瘤体积缩小,予以肿瘤扩大切除,术后3年随访下肢功能恢复良好,行走步态大致正常,可完成下蹲、跳跃、跑步等动作(图4)。
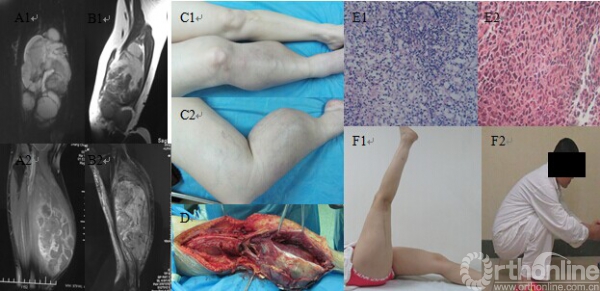
图4:患者,女,35岁。A1、A2,化疗前MRI:右下肢巨大软组织肿瘤,自右股部中下段后方至右小腿后方,边界不清,呈高低混杂信号影,与周围血管关系不清;B1、B2,2周期术前化疗后MRI:下肢肿瘤体积缩小,边界逐渐清晰,水肿带消失;C1、C2,术前外观,软组织肿瘤侵及范围广泛,瘤体巨大,肿瘤侵及自大腿后方至小腿后方,单纯切除困难;D,2周期化疗予以手术扩大切除,术中可见软组织肿瘤边界清晰,包膜完整,于包膜外切除范围广泛;E1,化疗前穿刺病理示小细胞恶性肿瘤,考虑为原始神经外胚层瘤(光镜 HE×200);E2,术后病理示肿瘤细胞退变,部分坏死(光镜 HE×200);F1、F2,术后3年随访,右下肢功能良好,可完成下蹲、跳跃、跑步等活动。
目前应用于STS的化疗药物中,ADM和IFO是主要代表药物,其单独治疗STS的有效率为14%~30%[17],而大剂量ADM+IFO(AI)联合应用的有效率可提高至35%~45%[18]。根据化疗药物针对肿瘤细胞增殖周期作用的不同,选择联合用药能够提高疗效。Henshaw等[19]应用新辅助化疗治疗巨大肢体及骨盆高度恶性STS患者134例,术前给予DDP120mg/m2+ADM 60mg/m2化疗共2个周期,术后给予4个周期此方案化疗,同时增加了2个周期大剂量IFO14g/m2化疗,平均随访5年,无瘤生存率达到80%,总存活率88%。本组中应用DIA方案化疗,用药剂量及化疗周期与之不同:由于ADM的累积心脏毒性,本组中控制了其用量,并且在术前化疗中就加入了IFO,三种药物的联合应用,对于肿瘤细胞增殖的各个周期均有持久、稳定的控制作用。本组患者耐受性良好,依从性高,参照 ECCO实体瘤疗效评价标准(RECIST 1.1), 28例中CR0例,PR12例,SD14例,PD2例,客观缓解率ORR为42.9%,疾病控制率DCR为92.9%。因此,该化疗方案治疗肢体STS疗效确切。
综上所述,应用DIA方案治疗肢体STS,术前化疗可明显缩小软组织肉瘤的体积,减轻肿瘤周围的软组织水肿,可控制微小转移灶,可以很好地配合STS的手术切除;能够提高患者的生存率及无瘤生存率,有利于肢体STS的保肢治疗;尽管尚缺乏大样本、随机对照研究进一步证实,但该方案近中期疗效满意,不良反应可耐受,是治疗STS重要、有效的方法。
作者单位:山东济南,济南军区总医院骨病科
发表《中国骨与关节杂志》2015年1月第4卷第1期
参考文献
[1]American Cancer Society: Cancer facts & figures 2013.Atlanta:American Cancer Society,2013.
[2] Siegel R, DeSantis C, Virgo K, et al. Cancer treatment and survivorship statistics..CA Cancer J Clin,2012, 62:220–241.
[3] Bannasch H,Eisenhardt SU,Grosu AL,et al.The diagnosis and treatment of soft tissue sarcomas of the limbs.Dtsch Arztebl Int,2012, 108(3):32-38.
[4] Vraa S, Keller J, Nielsen OS, et al. Prognostic factors in soft tissue sarcomas: the Aarhus experience. Eur J Cancer,1998, 34(12):1876-1882.
[5] Chen A P, Setser A, Anadkat M J, et al. Grading dermatologic adverse events of cancer treatments: the Common Terminology Criteria for Adverse Events Version 4.0. Journal of the American Academy of Dermatology,2012, 67(2): 1025-1039.
[6] Eisenhauer E A, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). European journal of cancer,2009, 45(2): 228-247.
[7]于秀淳,刘晓平,周银,等.肢体恶性软组织肿瘤的保肢治疗.中国骨肿瘤骨病,2002,1(1):32-34.
[8] Krikelis D and Judson I. Role of chemotherapy in the management of soft tissue sarcomas.Expert Rev Anticancer Ther,2010, 10(2):249-260.
[9] Judson I,Ratford JA ,Harris M,et al.Randomized phase Ⅱ trial of pegylated liposomal doxorubicin(DOXIL/CAELYX) versus doxorubicin in the treatment of advanced or metastatic soft tissue sarcoma:a study by the EORTC. Soft Tissue and Bone Sarcoma Group .Eur J Cancer,2001, 37(7):870-877.
[10] Nielsen OS,Judson I,van Hoesel Q,et al. Effect of high-dose ifosfamide in advanced soft-tissue sarcomas,A multicentre phaseⅡstudy of the EORTC soft tissue and bone sarcoma group .Eur J Cancer,2000, 36(1):61-67.
[11] Pervaiz N,Colterjohn N,Farrokhyar F,et al. A systematic meta-analysis of randomized controlled trials of adjuvant chemothorapy for localized resectable soft-tissue sarcoma.Cancer,2008, 113(2):573-581.
[12] Margaret M,R. Lor Randall,Robert SB,et al. Soft Tissue Sarcoma, Version 2.2014,Featured Updates to the NCCN Guidelines. J Natl Compr Canc Netw,2014, 12(1):473-483.
[13] Grimer R,Judson I,Peake D,et al. Guidelines for the management of soft tissue sarcoma .Sarcoma 2010,2010:506182.
[14] Grier HE,Krailo MD,Tarbell NJ,et al. Addition of ifosfamide and etoposide to standard chemotherapy for Ewing’s sarcoma and primitive neuroectodermal tumor of bone.N Engl J Med,2003, 348(8):694-701.
[15] Grist WM,Anderson JR,Meza JL,et al. Intergroup rhabdomyo-sarcoma study-IV:result for patient with nonmetastatic disease.J Clin Oncal,2001, 19(12):3091-3102.
[16] Gortzak E,Azzarelli A,Buesa J,et al. A randomised phase II study on neo-adjuvant chemotherapy for “high-risk”adult soft-tissue sarcoma.Eur J Cancer,2001, 37(9):1096-1103.
[17] O’Byrne K and Steward WP. The role of chemotherapy in the treatment of adult soft tissue sarcomas.Oncology,1999, 56(1):13-23.
[18] Steward WP,Verweij J,Somers R,et al. Granulocyte-macrophage colony-stimulating factor allows safe escalation of dose-intensity of chemotherapy in metastatic adult soft tissue sarcoma:a study of the European Organization for Research and Treatment of Cancer Soft Tissue ang Bone Sarcoma.J Clin Oncol,1993, 11(1):15-21.
[19] Henshaw RM,Priebat DA,Perry DJ,et al. Survival after induction chemotherapy and surgical resection for high-grade soft tissue sarcoma.Is radiation necessary? Ann Surg Oncol,2001, 8(6):484-495.





 京公网安备11010502051256号
京公网安备11010502051256号