拷贝数变异对多发骨肉瘤临床分型与耐药机制的影响
2015-04-14 文章来源:张浩强 王臻 鲍莉 刘梦捷 高鹏 肖鑫 耿磊 袁玉林 陈国景 朱皓东 付军 王岭 郭征 李靖 栗向东 范宏斌 我要说
多发骨肉瘤(multiple osteosarcoma,MOS)是一种相对少见但侵袭性更强的骨肉瘤,最早于1936年由Silverman报道。指患者存在两个或者两个以上的骨肉瘤病灶但不伴有肺转移或内脏转移,也称为多中心骨肉瘤(multicentric osteosarcoma, MCOS)或多病灶骨肉瘤(multifocal osteosarcoma, MFOS)。多发骨肉瘤分为两类,最初诊断时发现多病灶即定义为同时型多发骨肉瘤(synchronous multifocal osteosarcoma),而在对原发灶有效的初始治疗后患者出现新的病灶则定义为异时型多发骨肉瘤(metachronous multifocal osteosarcoma)。多发骨肉瘤的诊断需满足: a. 骨核素扫描、X线片检查提示骨肉瘤多发病灶;b. 胸部CT检查排除肺转移;c. 病灶组织经活检病理确诊的骨肉瘤。文献报道异时型多发骨肉瘤较同时型多发骨肉瘤预后相对较好。骨肉瘤是最常见的原发骨肿瘤,发病人数约为每年(4-5)/106。而多发骨肉瘤仅占全部骨肉瘤的1.0%~3.6%。
多发骨肉瘤的发病机制目前仍然存在很大争议,部分学者认为多发骨肉瘤可能是多中心起源的,也有学者认为多发骨肉瘤只是原发病灶发生骨转移而不伴有肺转移或内脏转移。之前解释这一问题的论据大都来自于多发骨肉瘤患者临床现象的观察,以及细胞系的基础研究,没有在更深的层面上解释多发骨肉瘤的发病机制。近年来,肿瘤基因组分析已经成为肿瘤研究的一个极其重要的组成部分,研究者们认为探寻疾病的基因变异是目前分子诊断、分子治疗及个体化治疗的关键,由于确定疾病的驱动基因常常受到检测指标的多少和可用数据统计模式的制约,而基因组结构变异(structural variation,SV),尤其是大片段序列(>1Kb)中的拷贝数变异(copy number variation,CNV)在某些区域上其形成速率甚至要大于单核苷酸变异(single nucleotide variation,SNV)的速率,近年研究证实拷贝数变异与疾病的临床表型具有很大的关联性,能够更便捷地用于研究疾病的发病机制,且有助于个体化治疗的实施。
随着基因测序技术以及肿瘤分子生物学的飞速发展,目前已证实致癌基因 HER2、c⁃myc、c⁃fos、MDM2、SAS,抑癌基因TP53、Rb、p16等在骨肉瘤的发生中较常出现异常改变,CD44、MMP⁃9 和 nm23 等与骨肉瘤的肺转移相关。Jinghui Zhang以及Michael A.Dyer等人利用全基因测序技术,检测青少年骨肉瘤患者肿瘤组织,检测到TTP53, RB1, MYC, PTEN,ATRX, LSAMP-AS3,CCNE1,COPS3,PMP22,MAPK7,NCOR1,以及UBB等基因的变异。截至目前,尚未发现多发骨肉瘤的基因测序的相关报道。外显子组(exome)是指一个个体的基因组DNA上所有蛋白质编码序列 (即外显子,exon) 的总和。在人类基因中大约有180,000个外显子,仅占人类基因组的1%,约30MB。人类基因组的蛋白编码区大约包含85%的致病突变。外显子组测序主要用于识别和研究与疾病、种群进化相关的编码区及非编码区(UTR)区域内的结构变异。结合大量的公共数据库提供的外显子数据,有利于更好地解释所得变异结构之间的关联和致病机理。
本研究利用外显子组测序平台,希望通过检测在我科诊治的2名多发骨肉瘤患者的肿瘤组织以及正常组织的外显子组,分析肿瘤组织的突变基因,以及CNV等,以解释多发骨肉瘤是同时发生的多处原发骨肉瘤,还是持续性转移导致的较极端的多发骨肉瘤。并讨论多发骨肉瘤临床学行为即恶性程度高、病情进展迅速以及化疗药物不敏感等与其病灶CNV之间的关系。
资料与方法
样本的提取与储存两例
组织提取
在两名患者手术时在无菌操作下提取组织样本。病例一患者取材部位包括左股骨远端骨肉瘤组织、左胫骨近端骨肉瘤组织、左股骨截肢平面上端正常组织;病例二患者取材部位包括肱骨近端骨肉瘤组织、右胫骨近端骨肉瘤组织以及正常组织。每部位各取 2~3 块,每块黄豆大小,不少于200 mg。取出后迅速放入冻存管(CORNING 1.8ml)中,并在取出后30 min内置于液氮中保存。
血液提取
术前采集患者的外周血标本 3~5 ml,迅速放入乙二胺四乙酸(EDTA)抗凝管中,并在血液离体后30min内置于-80℃冰箱中储存。
外显子组测序
(一)基因组DNA的提取
标本DNA的提取采用DNA试剂盒(Qiagen公司,德国),提取的过程按照说明操作。将骨肉瘤组织标本转移到1.5 ml微型离心管中,并迅速加入180 μl ATL缓冲液。待到与室温(25℃)平衡后,加入蛋白酶K并摇晃混匀。将标本管在56℃过夜,待到组织细胞完全溶解后,加入200 μl AL缓冲液摇晃混匀。再加入200μl体积分数为 96%~100%的乙醇。将所得混合物装载到试剂盒所提供的QIAamp MiniElute 离心柱上,分别用AW1和AW2缓冲液洗涤。在加入60μlAE缓冲液后,DNA将被洗脱。保存在-20℃冰箱。
(二)DNA样品的检测
样品为已经完成提取总DNA的溶液。对DNA样品的检测主要包括3种方法:(1)琼脂糖凝胶电泳分析DNA降解程度以及是否有RNA污染。(2) Nanodrop检测DNA的纯度(OD260/280比值)。(3) Qubit 对DNA浓度进行精确定量。其中OD值在1.8~2.0之间,含量在 1.5ug以上的DNA样品被用来建库。
(三)建库及测序
采用 Agilent 的液相芯片捕获系统,对人的全外显子区域 DNA 进行高效富集,然后在Hiseq2000 上进行高通量、高深度测序。建库和捕获实验采用 Agilent SureSelect Human AllExonV4 试剂盒,严格使用说明书推荐的试剂和耗材、并参照最新的经过优化的实验流程进行操作。
实验基本流程:将基因组DNA经Covaris破碎仪随机打断成长度为180-280bp的片段,末端修复和加A尾后在片段两端分别连接上接头制备DNA文库。带有特异index的文库pooling后与多达340,000个生物素标记的探针进行液相杂交,再使用带链霉素的磁珠将20,965个基因的334,378个外显子捕获下来,经PCR线性扩增后进行文库质检,合格即可进行PE100测序。
四、数据分析
测序得到的原始测序序列,里面含有带接头的、低质量的测序序列,会对后续信息分析造成很大干扰。为了保证信息分析质量,必须对测序后的原始数列进行精细过滤,得到纯净的序列,后续分析都基于这些纯净的测序序列。测序错误率与碱基质量有关,受测序仪本身、测序试剂、样品等多个因素共同影响,控制每个碱基位置的测序错误率低于1%。然后分析GC含量分布,确保建库以及测序的准确性。而且测序数据的质量主要分布在Q20以上,这样才能保证后续高级分析的正常进行。根据illumina的测序特点,使用双端测序的数据,要求Q20比例在90%以上,Q30比例在85%以上,误差在0.1%以下。
五、统计学分析
采用GraphPad Prism 6(GraphPad软件公司,加拿大)统计学软件包进行统计学分析。药物敏感基因CNV变异率的分析运用两样本率的比较、方差分析以及 t检验。 检验水准p值取双侧0.05。
结果
两例患者在活检后均接受了标准的新辅助化疗,并于化疗后接受外科手术。患者一化疗效果不佳,新辅助化疗2次后接受股骨中上段截肢手术,并接受术后化疗。术后3个月患者发生肺转移。另一位患者术前接受了4次新辅助化疗,接受了切除左肱骨近段、右胫骨近端肿瘤的手术,并接受术后化疗。
一、治疗结果
病例一患者接受了骨肉瘤标准的新辅助化疗+手术+辅助化疗系统治疗,但其在2014年7月术后第3次入院化疗时复查胸部CT示肺部多发结节,结合临床,转移可能性大;2014年9月复查胸部CT提示肺部结节较前(2014年7月)增大增多,考虑肺部多发转移;2014年11月初复查胸部CT提示肺部转移灶较前(2014年9月)增大增多(图9)。 2014年11月初患者复查左下肢截肢残端,未查及明显异常。
图9:胸部CT平扫。选取与图2相同的水平位胸部CT平扫。双肺野清晰,肺纹理规整,双肺见多发结节影,最大径约3.5cm。气管支气管通畅,未见狭窄或阻塞征,肺门影不大。纵膈结构清楚,心后可见一直径约6.7cm的软组织影,气管旁、隆突前下、血管前及腔静脉后未见肿大淋巴结。双侧胸膜无增厚,未见胸腔积液。胸11椎体可见环状高密影。双肺多发转移瘤,胸11转移灶可能。病例二患者接受1个疗程异环磷酰胺方案化疗后,左小腿疼痛症状明显减轻。
二、外显子组测序结果
(一)Somatic SNV检测及分析
测序结果显示两例患者其各自三处样本间相同序列的部分占绝大多数,首先在基因层面验证了所分析的每组标本均来自同一个体。分析患者两处肿瘤组织的SNV,数据显示两者重叠部分均较多,提示两处肿瘤为同源性,说明两例患者多发肿瘤为均肿瘤转移所致的,并非多中心起源的肿瘤。图1、2分别表示两例患者各自两处肿瘤病灶发生SNV重要基因的交集维恩图。其中患者一两处病灶组织共发现有99个SNV基因变异,两处病灶共有的45个发生SNV的变异基因中,有基因MITF,是癌症体细胞突变目录(Catalog of Somatic Mutations in Cancer,COSMIC)所收录的肿瘤相关性很高的一个基因,为3p13位点发生的错义变异,密码子变化为[TTG=>TTC];[=],肿瘤变异率为35.70%。而该患者胫骨近端肿瘤病灶独有的29个发生SNV的变异基因中,包含有PIK3、HNRNPA2B1以及KMT2A这三个COSMIC基因变异,均为错义变异。其中PIK3位于3q26.32,密码子变化为[GAG=>AAG];[=],肿瘤变异率为23.80%;HNRNPA2B1位于11q23.3,密码子变化为[ATT=>ACT];[=],肿瘤变异率为3%;KMT2A位于11q23.3,密码子变化为[TCT=>TTT];[=],肿瘤变异率为16.40%。分析该患者股骨远端肿瘤病灶SNV,共有25个独有的变异基因,但没有COSMIC所包含的。然而另一名患者两处肿瘤病灶共有48个SNV变异基因,而两者共有的则是21个重要的SNV变异基因。此外,该患者右胫骨近端肿瘤病灶独有20个SNV变异基因,同时其左肱骨近段肿瘤病灶SNV分析存在7个独有的变异基因。但是,该患者两处肿瘤病灶组织中均未识别出COSMIC所收录的基因变异。
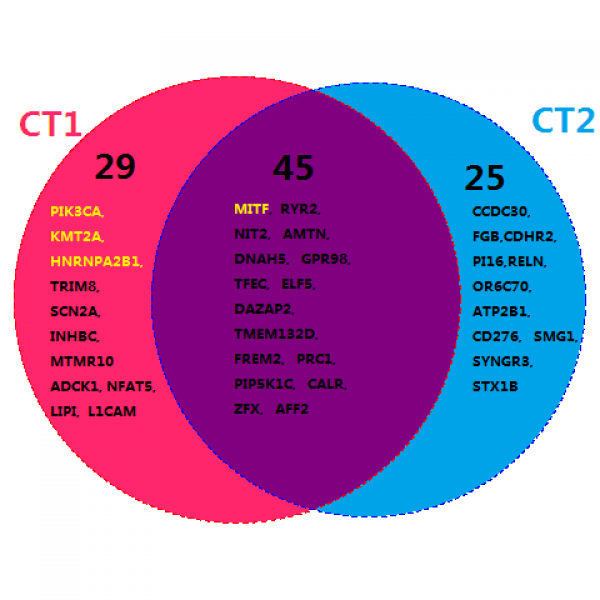
图1:患者一SNV重要基因的交集维恩图。CT1指该患者左胫骨近端病灶组织,CT2指该患者左股骨远端病灶组织。该图表示此患者两处病灶共有的SNV重要基因有45个,而胫骨近端病灶独有的有29个,股骨远端病灶独有的有25个。其中黄色字体显示的基因,即共有部分的MITF基因以及胫骨近端病灶部分的PIK3A、KMT2A、HNRNPA2B1基因为COSMIC基因。在近年来肿瘤研究中均发现它们在肿瘤的发生发展进程中发挥重要作用。图中所列均为数据分析后认为较为重要的基因。
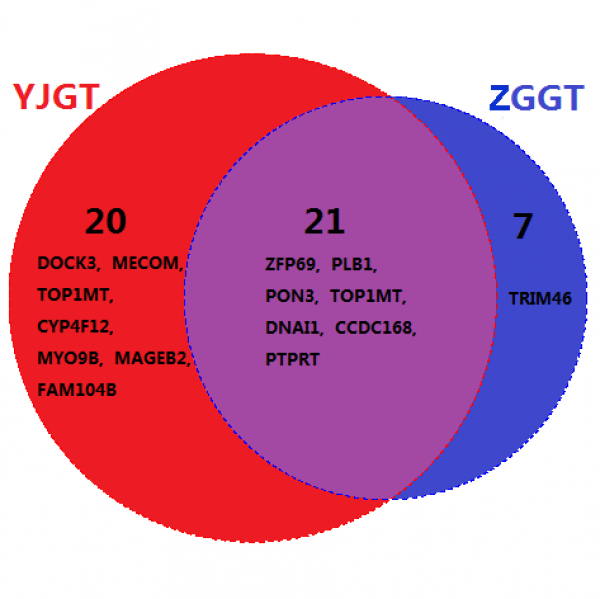
图2:患者二SNV重要基因的交集维恩图。YJGT指该患者右胫骨近端病灶组织,ZGGT指该患者左肱骨近端病灶组织。该图表示此患者两处病灶共有的SNV重要基因有21个,而胫骨近端病灶独有的有20个,肱骨近段病灶独有的有7个。图中所列均为数据分析后认为较为重要的基因。
通过对比分析上述两例患者肿瘤组织中共有的SNV变异基因,虽然没有发现重合的变异基因,但是存在同一族的变异基因重合,如:KMT、SCN以及TMEM等。
(二)Somatic CNV检测及分析
通过分析两例患者多发病灶somatic CNV,识别到众多染色体均存在十分显著的CNV,其涉及的基因数目显著大于SNV,并以拷贝数增多为主。通过分析得到两例患者的两处肿瘤组织之间的CNV趋势大致相同,但是胫骨近端肿瘤组织的CNV幅度大于另外一处肿瘤组织。其中患者二其右胫骨近端肿瘤组织的CNV幅度明显大于左肱骨近端肿瘤组织,前者变异幅度大致为后者的2倍。图3、4分别为两例患者两处肿瘤病灶根据CNV数据所绘制的Circos图,图中可以清楚地看出两处病灶CNV的趋势及其幅度。由于TP53基因没有发生SNV,在CNV分析中我们重点观察了它的变化,其位于17p13.1位点,在CNV分析数据中我们在此位点处识别到明显的CNV,而且均以拷贝数的减少为主。其中患者一左胫骨近端病灶TP53拷贝数减少66%,而左股骨远端病灶该基因拷贝数减少达37%(图5)。另一例患者TP53基因,右胫骨近端病灶TP53拷贝数减少23%,而左肱骨近段病灶该基因拷贝数减少也有12%(图6)。
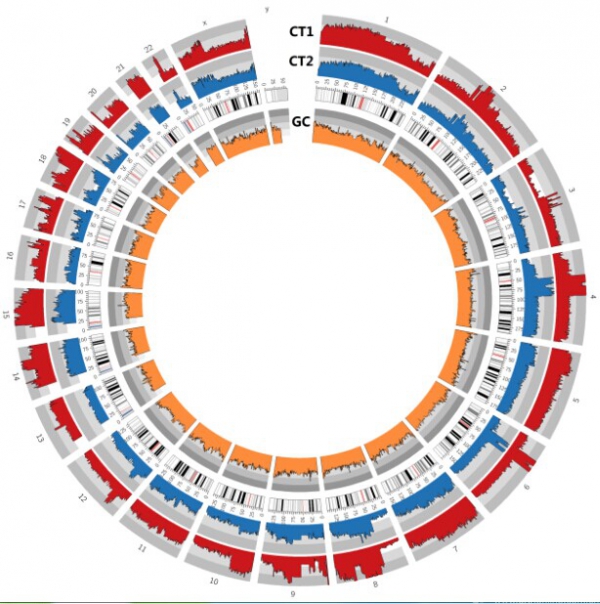
图3:患者一CNV变异的Circos图。该图从内向外顺序:最内圈表示GC值;第二圈表示染色体;第三圈蓝色波状图表示该患者左股骨远端病灶CNV;第四圈红色波状图表示该患者左胫骨近端病灶CNV。从图中可以看出这两个病灶他们CNV的变化趋势是大致相同的,只是存在变异趋势上的差异。
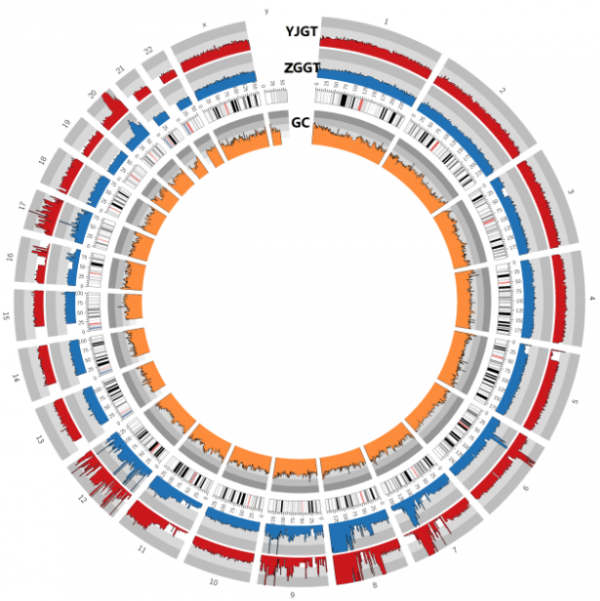
图4:患者二CNV变异的Circos图。该图从内向外顺序:最内圈表示GC值;第二圈表示染色体;第三圈蓝色波状图表示该患者左股骨远端病灶CNV;第四圈红色波状图表示该患者左胫骨近端病灶CNV。从图中可以看出这两个病灶他们CNV的变化趋势是大致相同的,只是存在变异上的差异。
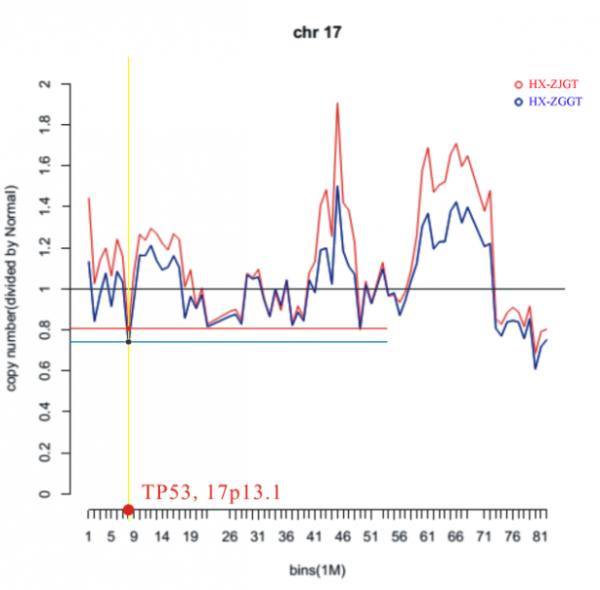
图5:患者一17号染色体CNV示意图。该波状图表示此患者第17号染色体CNV变化,基线值为1,对应二倍体。红色线条表示左胫骨近端病灶组织所识别的变异,蓝色线条表示左股骨远端病灶组织所识别的变异。可以看出,两者变化的趋势大致相同,红色波状图的变化幅度稍大于蓝色波状图。TP53基因位于短臂13.1的位置,即数据量7,565,097B的坐标位置。
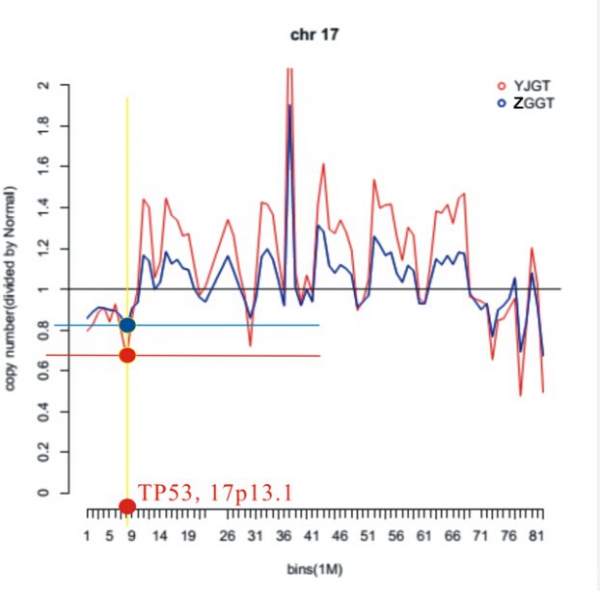
图6:患者二17号染色体CNV示意图。该波状图表示此患者第17号染色体CNV变化,基线值为1,对应二倍体。红色线条表示左胫骨近端病灶组织所识别的变异,蓝色线条表示左股骨远端病灶组织所识别的变异。可以看出,两者变化的趋势大致相同,红色波状图的变化幅度稍大于蓝色波状图。观察TP52基因在此患者的变异,TP53基因位于短臂13.1的位置,即数据量7,565,097B的坐标位置,进过计算可以得出此患者左胫骨近端病灶TP53拷贝数减少23%,而左股骨远端病灶该基因拷贝数减少12%。
(三)分子靶向药物敏感基因somatic CNV检测与分析
利用已经处理结束的CNV数据,对目前分子靶向药物所对应的比较重要的基因进行分析。患者一,两处病灶共有CNV基因有244个,胫骨近端病灶独有的有38个,而股骨远端独有的有34个。该患者分子靶向药物相关的CNV基因中,共有部分有39个COSMIC基因,胫骨近端独有的有6个,股骨远端独有的有7个。另一例患者两处病灶共有的发生CNV的基因有128,右胫骨上端病灶独有的有34个,左肱骨近端病灶独有的有72个。该患者分子靶向药物相关的CNV基因中,共有部分有22个COSMIC基因,胫骨近端独有的有5个,股骨远端独有的有9个。
对患者一左胫骨近端及股骨远端病灶所识别的共有的分子靶向药物敏感基因CNV进行统计,并结合其拷贝率进行数据分析。设定正常二倍体拷贝率为100%,拷贝数增加则拷贝率大于100%,拷贝数减少则拷贝率小于100%。该患者左胫骨近端病灶CNV变异率为(133.5±2.957)%,左股骨远端病灶CNV变异率为(113.1±1.856)%。因为所选CNV基因为两处病灶共有,故选择配对t检验。双侧p < 0.0001,两处病灶间相同的基因拷贝数变异度存在显著的统计学差异,该患者左胫骨近端病灶变异率明显大于左股骨远端病灶变异率。t值为13.01,自由度为243。并对该组配对的差异进行分析,平均值的差异为-20.35,标准偏差的差异为24.45,标准误差的差异为1.565,95%可信区间为(-23.44 , -17.27),R2=0.4104。最后验证了基因配对的有效性,统计其相关系数为0.8875,单侧p值<0.0001,配对正确有效。
患者二右胫骨近端病灶CNV变异率为(136.1±10.84)%,左肱骨远端病灶CNV变异率为(122.3±5.524)%。双侧p = 0.0335,两处病灶间相同的基因拷贝数变异度存在相对明显的统计学差异,该患者右胫骨近端病灶变异率明显大于左肱骨远端病灶变异率。t值为2.150,自由度为128。并对该组配对的差异进行分析,平均值的差异为-12.80,标准偏差的差异为67.39,标准误差的差异为5.956,95%可信区间为(-24.59 , -1.018),R2=0.0351。最后验证了基因配对的有效性,统计其相关系数为0.9397,单侧p值<0.0001,配对正确有效。
经过观察分析2位患者4处病灶的分子靶向药物敏感基因,患者一的两处病灶共有的CNV部分与焦某两处病灶共有的CNV部分依旧存在着相同的CNV变异基因。进过统计两位患者4处骨肉瘤病灶所共有的发生CNV的基因共有68个,将这组数据进行单向方差分析(One-Way ANOVA),可以得出F=5.307,p值为0.0197,数据间存在统计学差异。随后对四组数据进行组间交叉对比分析。
通过分析两例患者各自两处肿瘤组织之间的大片段的拷贝数变异,发现TP53等抑癌基因发生CNV,随后结合临床表现,初步判断出两例多发骨肉瘤患者原发病灶均为胫骨近端病灶。分析患者肿瘤病灶化疗药物敏感基因的变异、分子靶向药物敏感基因差异以及耐药基因,发现患者甲两处肿瘤组织中均存在耐药基因以及大量的药物敏感基因变异。
讨论
本研究首次应用第二代测序技术检测多发骨肉瘤患者多病灶全外显子组,分别分析两例患者各自两处肿瘤组织的SNV,提示两处肿瘤为同源性,即本研究中两例患者的多发肿瘤均为肿瘤转移所致的,并非多中心起源的肿瘤。分析患者一的SNV时发现PIK3以及HNRNPA2B1这两个驱动基因变异在该患者肿瘤的进程中发挥重要作用。通过分析两例患者各自两处肿瘤组织之间的大片段的CNV,发现TP53等抑癌基因发生CNV变异,结合临床表现,初步判断出两例多发骨肉瘤患者原发病灶均为胫骨近端病灶。
本研究初步结果表明通过分析多发骨肉瘤患者多发病灶的基因SNV,能够判断多发骨肉瘤病灶是否同一起源。本文两例患者其外显子组测序结果中SNV重合部分较多,而且绝大多数为杂合子。由于肿瘤的遗传异质性,两处肿瘤同时发生相似甚至相同的几率极其的小,因此推断出该患者的两处肿瘤病灶为同源肿瘤,即一处为原发骨肉瘤病灶,另外一处为骨肉瘤转移病灶。分析患者一的SNV,胫骨近端肿瘤病灶中含有分别3号染色体上的PIK3CA以及7号染色体上的HNRNPA2B1 等,这二者均为COSMIC基因,在人类多种肿瘤的发生过程中起重要作用,例如其中PIK3CA 的突变已经被证明与多种癌症的发病机理相关,例如乳腺癌(25%)、结肠癌(14%)、胃癌(9%)、肺癌(4%)与子宫内膜癌(23%)等。随后分析CNV数据,发现这两例骨肉瘤患者基因均存在十分显著的CNV,而且两例患者各自多发病灶的CNV趋势大致是相同的,只是在某些区域存在差异,而且组织间的变异程度存在明显的统计学差异。肿瘤在体内时间越长,其所呈现出的异质性就越明显,基因的变异程度也应该更大,这样可以初步推断出这两例同源性多发骨肉瘤患者的原发病灶均为胫骨近端病灶。而且本研究重点观察以及验证了重要的抑癌基因TP53在其中的变化,证实多发骨肉瘤患者TP53是存在CNV形式的变异,然而在其他肿瘤中,TP53的变异以SNV多见,我们认为TP53这种形式的变异,其灾难性要远远大于一般形式的变异。或许通过研究肿瘤相关基因的CNV变异这一新的视角可以揭示此类肿瘤恶性程度高的原因。分子靶向药物敏感基因的对比分析结果显示出不同患者、不同病灶会发生不同的变异形式以及变异程度,而且对于化疗药物敏感基因的分析也得出了类似的结论。本研究初步认为通过对化疗药物以及分子靶向药物敏感基因的CNV进行分析,可以进一步解释化疗效果差异的深层次原因。与Chen X, Bahrami A等人在Cell Report报道的青少年骨肉瘤全基因组测序所得到的数据进行对比,Chen等人报道儿童骨肉瘤患者大多以SNV为主,CNV变异不具有显著性差异,而本研究测序数据显示多发骨肉瘤患者CNV相比SNV更具有意义,例如在SNV检测中并未检测到TTP53变异,而在CNV中则检测到了TTP53基因发生了很大程度的拷贝数减少,发生了基因缺失。所以,本研究初步认为以CNV为主是多发骨肉瘤基因异常的表现特征之一。
多发骨肉瘤最早报道于1936年,迄今为止见于文献报道的病例约300例。多发骨肉瘤分型现多采用Amstutz分型法:根据患者的年龄、病灶的病理组织学表现以及多个病灶出现的时间等,将多发成骨肉瘤分为Ⅰ、Ⅱ、ⅢA、ⅢB型。Ⅰ、Ⅱ型即同时型多发骨肉瘤,即在骨肉瘤确诊后5月之内,全身多处骨骼出现骨肉瘤病灶。Ⅰ型患者年龄常小于18岁,骨肉瘤细胞分化不良,恶性程度高。Ⅱ型患者年龄常大于18岁,骨肉瘤细胞分化好,恶性程度低。ⅢA、ⅢB 型即异时型多发骨肉瘤。ⅢA指骨肉瘤确诊后6~24个月全身多处骨骼出现骨肉瘤病灶的患者;ⅢB型指骨肉瘤确诊24个月以后全身多处骨骼出现骨肉瘤病灶的患者。1979年Mahoney等部分修正了上述分型,建议以A、B、C、D型对应Ⅰ、Ⅱ、ⅢA、ⅢB型。两种分型均认为,分型越高预后相对越好。本文研究对象均为同时型成年患者,分型应为Ⅱ/B,分型提示恶性程度相对较高。患者一的临床表现及其预后均符合该分型所对应的一般情况。
Jaffe以及Brandal通过观察数十例多发骨肉瘤患者,发现有些患者会并发抑癌基因TP53变异的相关肿瘤,而且Iavarone等人通过研究骨肉瘤患者肿瘤组织DNA也发现了TP53基因存在突变。说明多发骨肉瘤患者本身存在基因突变的特质,促使了多发骨肉瘤的发生,认为多发骨肉瘤为多中心的原发骨肉瘤。而Bacci等通过观察16例同时型多发骨肉瘤患者,发现13例患者的多发病灶对化疗的组织学反应是一致的,证明多发骨肉瘤并不是多中心起源的,而是从原发病灶转移至全身其他部位。2011年Yamamoto等人报道了他们的研究结果,他们利用DNA基因芯片分析、实时定量PCR以及和端粒酶测定等技术研究多发骨肉瘤患者不同病灶细胞系的细胞生物学和基因表达,发现不同病灶的生物学信息以及基因表达具有相似性,首次在细胞学以及基因层面上解释了多发骨肉瘤同一来源的假说。本研究利用二代测序技术检测多发骨肉瘤患者正常组织以及不同病灶骨肉瘤组织的外显子组,通过分析发现,两处病灶之间的基因信息相似,说明其来自于同一个体而且两处病灶是同一来源,在基因学层面支持骨-骨转移假说。然而该患者两处肿瘤的化疗敏感性存在差异,股骨远端较胫骨近端敏感,但是一般认为骨肉瘤的原发灶与转移灶具有一致的化疗敏感性。在Bacci的报道中,有3例同时型多发骨肉瘤患者的不同病灶之间化疗效果不一致,而本病例也属于同时型多发骨肉瘤。说明不同的多发骨肉瘤患者其各病灶之间的化疗敏感性具有明显的个体差异。个性化肿瘤治疗的概念依赖于从肿瘤基因组分析收集得到的数据,就像维罗菲尼这一BRAF基因突变特异抑制剂成功用于治疗转移性黑素瘤。本研究通过基因组学这一新的技术平台,从基因层面解释了该名多发骨肉瘤患者的多发病灶为骨-骨转移所致。
目前对多发骨肉瘤的生存率尚缺乏大宗病例统计, 但一般认为治疗多发骨肉瘤的原则应基本与骨肉瘤相同,即大剂量化疗联合手术的综合治疗模式。而且多发骨肉瘤的发病率低, 临床相关研究较少,且进展较快,所以临床预后较差。JAFFE等认为,多发骨肉瘤患者一旦诊断应积极地进行以化疗和手术为主的综合治疗,其中大剂量化疗方案仍以阿霉素、 顺铂 、甲氨蝶呤、异环磷酰胺(ADM, DDP, MTX, IFO)为主,手术应该尽可能将肿瘤病灶彻底清除,BACCI等统计 42 例多发骨肉瘤患者,经过积极的综合治疗后,中位生存时间仅23个月,其中病灶的数目、原发病灶是否手术切除、多发瘤灶的手术切除数目影响患者的预后。通过新辅助化疗,多发骨肉瘤瘤灶能部分缩小甚至消退,所以对新辅助化疗的敏感程度直接决定能否将瘤灶手术切除, 阿霉素、顺铂、甲氨蝶呤、异环磷酰胺联合的方案是目前公认的对骨肉瘤最有效的新辅助化疗方案之一。本文中患者一接受了术前新辅助化疗,化疗方案为LBP(30mg/m2)-ADM(60mg/m2)、IFO(10g/m2),因为该患者化疗效果不佳,故化疗2个疗程后即选择外科干预。文献报道多发骨肉瘤因尽可能将肿瘤病灶清除干净,结合患者及其家属的意见,选择左股骨中上段截肢术,术后进行化疗药物敏感性检测并按照结果给予辅助化疗。然而,该患者化疗效果依旧不佳,在化疗过程中出现肺部广泛转移,胸椎疑似转移。可能与该类疾病多发机制相关。
综上可知,通过外显子组测序技术证实了本研究中两例多发骨肉瘤患者均为同源性肿瘤,而非多中心起源,通过分析显示其SNV以及CNV均存在差异,且以CNV的差异最为突出。经过对两例患者4处癌灶的CNV进行深入分析后可以证实多发骨肉瘤恶性程度较高的原因为抑癌基因以及耐药基因的CNV变异。通过本研究以及阅读大量多发肿瘤文献,我们提出一个假说:多发骨肉瘤,甚至多发肿瘤的临床生物学行为与CNV具有直接的关系。本课题组期望通过收集更多癌种、更多病例,对其进行基因侧学,研究多发特性与肿瘤病灶somatic CNV之间的联系,来探讨研究多发肿瘤新的研究以及诊疗方向。通过本研究可以看出外显子组测序在疾病基因的识别和分子诊断中表现出极大的优越性,尤其是在肿瘤研究方面具有其他检测手段所不能比拟的先进性。但由于外显子组测序集中于对外显子区域的测序,而外显子组仅占全基因组很小一部分,从基因组水平上来看,得到的信息是不完整的,尤其是目前研究比较热门的microRNAs 编码区等区域的信息会被遗漏。还有外显子组测序所应用的研究策略导致该技术对大片段插缺等的DNA结构变异无能为力,而且对位于高度同源区的变异体难以检出只能借助其他方法。外显子组测序后得到的数据十分巨大,对这些大数据进行深入而精准的分析是全球基因研究者们的巨大挑战。
参考文献略
作者单位:第四军医大学西京医院骨科(张浩强 王臻 高鹏 肖鑫 耿磊 袁玉林 陈国景 朱皓东 付军 郭征 李靖 栗向东 范宏斌),天津华大基因研究所(鲍莉),第四军医大学西京医院血管内分泌外科(王岭),第四军医大学西京医院整形外科(刘梦捷)





 京公网安备11010502051256号
京公网安备11010502051256号