3D打印多孔钛合金与聚醚醚酮椎间融合器对羊颈椎融合效果的对比研究
2015-04-14 文章来源:第四军医大学西京医院骨科 李小康 伍苏华 李轶 张涌泉 郭征 我要说
椎间融合器被广泛应用于椎间盘退行性病变、颈椎肿瘤和创伤等疾病。目前临床使用的聚醚醚酮(Poly-ether-ether-ketone,PEEK)椎间融合器具有与骨组织相近的力学性能以及良好的生物相容性,取得了较好的临床疗效[1-5]。但是PEEK材料不能与周围骨组织形成紧密结合,可能导致融合器微动甚至最终失败[3,6-7]。多孔钛合金(Ti-6Al-4V)材料不仅具有良好的机械强度、耐腐蚀性和生物相容性,近年来的一些离体研究还发现其能够促进成骨细胞在其表面黏附和成骨分化[6,8-9]。这些研究结果表明,与PEEK相比,多孔钛合金或许能更好地与周围骨组织结合,从而达到更加稳定的融合。但实体钛合金过高的弹性模量会导致应力遮挡效应,从而限制其在椎间融合领域的应用[6]。多孔结构可以大幅减少钛合金的弹性模量,减少应力遮挡,同时可以提供更多的材料-骨接触面积,有利于材料与周围骨形成骨整合[10-12]。本研究采用3D打印技术(电子束熔融)制备的多孔钛合金椎间融合器在小尾寒羊颈椎融合模型上进行实验,并与临床广泛应用的PEEK椎间融合器对比,探讨3D打印多孔钛合金融合器的融合效果,为临床应用提供实验依据。
材料与方法
一、动物分组及实验设计
18只普通级雌性小尾寒羊(由第四军医大学西京医院动物实验中心提供),1~2岁龄,体质量为35~50 kg。每只羊行颈前路椎间盘切除术后,其C3-4与C4-52个椎间隙随机置入2种椎间融合器:3D打印多孔钛合金椎间融合器(实验组9只);PEEK椎间融合器+自体植骨(对照组9只)。术后3个月,所有实验动物均行颈椎正、侧位X线检查,两组均采用陆眠宁Ⅱ过量注射方法分别处死3只动物行Micro-CT及组织学检测;术后6个月,剩余12只动物行X线检查后全部处死,6只(两组各3只)动物用于Micro-CT及组织学检测,其余6只(两组各3只)动物用于生物力学检测。
二、置入材料
(一)多孔钛合金椎间融合器的制备(图1A)
采用计算机辅助设计(computer aideddesign,CAD)软件(Materialise/Magics,Materialise公司,比利时)设计多孔钛合金融合器的三维模型,将模型数据导入3D打印设备(Arcam A1,Arcam AB公司,瑞典)。3D打印制备流程如下:首先在650 ℃以30 mA的电子束流,以15 000 mm/s的扫描速度预热医用多孔钛合金粉末薄层,然后以6 mA的电子束流,400 mm/s的扫描速度由计算机控制,按照导入的模型数据逐层熔融金属粉末,最后制备成与数据模型一致的多孔钛合金融合器(图1A)。融合器规格:圆柱12mm´5 mm,孔隙率为(68.0±5.3)%,平均孔径(710±42) μm,弹性模量(2.5±0.2) GPa,压缩强度(63.0±4.7) MPa。(图1B)
(二)PEEK椎间融合器
PEEK融合器(MILESTONETM,威高骨科器械有限公司)的弹性模量为(4.1±0.3) GPa,压缩强度为(120.0±9.8)MPa。将其外形打磨成圆柱12mm´5 mm(图1B)。

图1 实验中所用椎间融合器及制备流程:通过计算机辅助设计及3D打印快速成型技术制备高孔隙率及孔连通性的多孔钛融合器(A);实验采用羊颈椎前路融合模型,选择临床常用的PEEK融合器作对照研究(B)
三、动物模型建立
(一)术前准备
术前行颈椎透视排除骨组织病变。术前36 h禁食,术前12 h禁水。仰卧位固定于特制手术台上。采用陆眠宁Ⅱ(1.8 mg/kg,吉林省华牧动物保健品有限公司)肌注麻醉。麻醉前肌注阿托品(0.05 mg/kg,天津药业集团新郑股份有限公司)以及抗生素(头孢唑林钠,1.0 g/只,山东鲁抗医药股份有限公司)。
(二)手术操作及术后处理
颈前右侧纵形切口,逐层显露后,沿正中颈白线电刀切开颈长肌,骨膜剥离器剥离,显露C3-5椎体前缘。切开C3-4及C4-5椎间隙纤维环后髓核钳咬除髓核,摆锯加磨钻处理相应终板,尽量清除非骨性组织,保留后纵韧带完整。生理盐水冲洗。2个椎间隙随机置入3D打印多孔钛合金椎间融合器或中央植骨的PEEK椎间融合器,颈前路钢板(CERVI-LOCKTM,威高骨科器械有限公司)固定。双氧水、生理盐水分别冲洗后检查无活动出血,放置明胶海绵。逐层逢合肌肉、筋膜和皮肤。羊清醒后开始进食,自由活动。术后连续3 d肌内注射头孢唑啉钠1 g,伤口未予特殊处理。
四、测量及观察指标
(一)X线及Micro-CT检测
陆眠宁Ⅱ(0.9mg/Kg)肌注麻醉后固定实验动物颈部,摄颈椎X线正、侧位X线片。在相应时间点处死动物后,切取C3-4及C4-5椎间置入物,两端各保留部分椎体,体积百分比10%福尔马林液固定1周后送Micro-CT检测(Inveon MMGantry-STD,西门子公司,德国)。扫描参数如下:旋转角度360°,分辨率21 μm,扫描电压80 KV,扫描电流500 μA。采用配套软件(COBRA,西门子公司,德国)进行三维重建及数据测量。计算材料中骨长入体积占材料孔隙体积的百分比(bone volumefraction,BVF),PEEK融合器的BVF值为中央植骨孔中骨体积百分比。
根据Micro-CT及X线结果评价融合等级:①未融合:明显透光区包绕融合器周围,无骨性桥接形成或孔隙中无骨长入;②部分融合:融合器周围有较小的透光区,但透光区范围不足材料-骨接触面的一半,可见骨组织长入孔隙之中并有部分骨性桥接形成;③融合:融合器周围无透光区,椎体间形成完整的骨性桥接。
(二)组织学检测
Micro-CT检测后,将标本脱水,聚甲基丙烯酸甲酯包埋。切片机(SP1600,莱卡,德国)于标本正中矢状位切片,磨片机(RF-1,瑞丰仪器有限公司,中国)磨至80~100 μm,滑石粉抛光。Stevenels’Blue & Van Gieson’s Picrofuchsin染色。显微镜(DM6000BUpright,莱卡,德国)100倍下采集包含置入物及其周围组织的区域,由显微镜自动将这些区域(12×12块)进行拼接。采用图片分析软件(Image-ProTMPlus,Media Cybernetics,美国)进行组织计量学分析。分别计算置入物内的矿化骨百分比(mineralized bonefraction,MBF)和材料-骨结合百分比(bone apposition,BA)。MBF为置入物孔隙中矿化骨面积占置入物孔隙面积的百分比。BA为置入物与骨紧密结合部分占置入物所有内外周长的百分比。
(三)生物力学检测
生物力学检测前,将标本置于室温解冻,去除标本表面的肌肉,保留韧带。将C4椎体从中切断,注意保护椎体后侧小关节。将得到的C3-4与C4-5测试节段做相应修整,以使每个测试节段的上下椎体具有相同的高度。将测试节段的上下椎体用螺钉与聚甲基丙烯酸甲酯固定于特制的固定圆盘中,放入力学机中进行旋转测试(WNJ1000,上海华龙测试仪器有限公司)与侧弯/屈伸测试(WDW100C,上海华龙测试仪器有限公司)。测试在室温下进行,加载速度为1.0 mm/s,最大力矩为±4 Nm。对每个测试节段预先应用两次最大力矩以减少标本的黏弹性作用。最后,测量到达最大力矩后下位椎体相对于上位椎体的角度位移范围(range ofmotion,ROM)。ROM值被广泛用于评价融合后椎体的力学稳定性。ROM值越小,说明相邻椎体相对微动越小,融合就越稳定。
五、统计学方法
应用SPSS19.0统计学软件,分别对实验组和对照组的两置入节段C3-4、C4-5的MBF、BA、BVF以及ROM值进行双因素方差分析,P<0.05认为差异有统计学意义。
结果
一、X线及Micro-CT结果
术后3、6个月的X线片示所有置入物均未出现移位。术后3个月,实验组可观察到骨组织长入3D打印多孔钛合金孔隙中,形成部分融合(图2A,B)。与PEEK融合器相比,3D打印多孔钛合金材料周围具有更小的透光区(图2箭头所示),提示其能更好地与周围骨组织整合。术后6个月,两组置入物周围X线透光区消失,3D打印多孔钛合金孔隙中骨组织长入更加明显。尽管两组融合器均形成完整骨性桥接,但Micro-CT提示多数PEEK材料周围仍存在微小空隙,而3D打印多孔钛合金材料则大部分与骨形成了紧密接触(图2C,D)。术后3~6个月,3D打印多孔钛合金孔隙中骨长入增长明显(BVF值从27.1%增加到39.7%),而PEEK融合器的BVF值则保持相对稳定(从37.6%增加到40.0%)术后3个月,两组间比较差异有统计学意义(F=7.417,P=0.023),术后6个月,两组间比较差异无统计学意义(F=0.17,P=0.898,图3)。
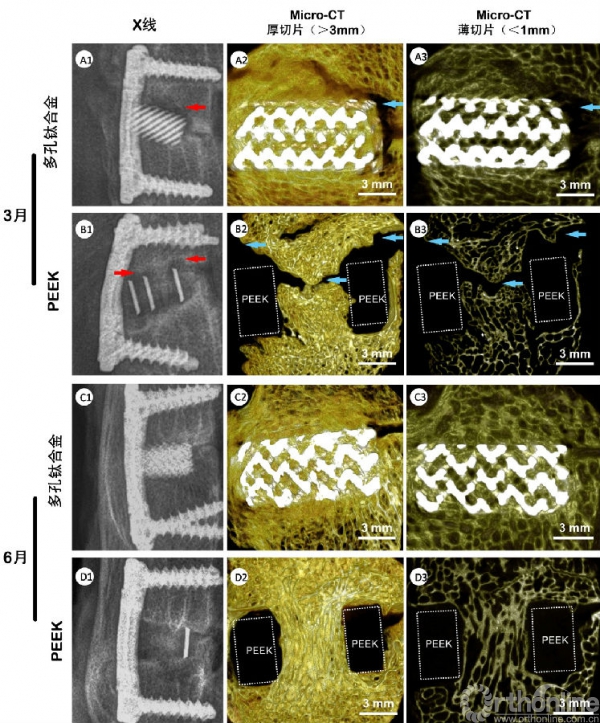
图2 两种融合器侧位X线及Micro-CT结果:术后3个月,可见3D打印多孔钛合金融合器周围的透光区域明显少于PEEK融合器(图中箭头所示);术后6个月,多孔钛合金大部分与周围骨组织形成了紧密接触,而多数PEEK材料周围仍存在微小空隙。注:Micro-CT图像是在融合器正中矢状位以两种不同切片厚度(>3mm或<1mm)进行重建而成。虚线框为PEEK材料边缘位置标记。
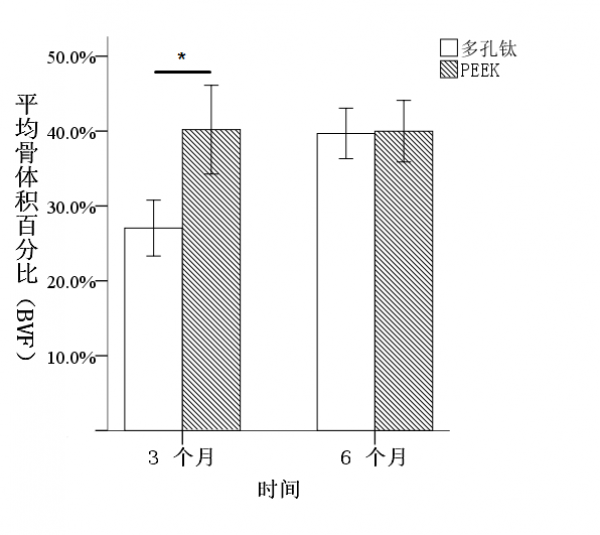
图3 骨体积百分比BVF(%):3D打印多孔钛合金孔隙中的骨体积百分比随时间增长,并在术后6个月时接近PEEK融合器中央植骨孔处的骨体积百分比。(方差分析,n=6,*P<0.01)
二、组织学结果
术后3个月,实验组3D打印多孔钛合金孔隙中可见新生骨小梁,纤维与软骨组织,无明显炎性反应,大部分材料周围仍覆盖一层纤维组织,骨小梁未与材料紧密结合。在一些钛合金表面可观察到软骨组织,形成软骨-材料紧密接触界面(图4 A,B)。与此同时,对照组PEEK材料则完全被纤维组织包绕,纤维层厚度明显大于多孔钛合金材料(图4 C,D)。
术后6个月,实验组3D打印多孔钛合金表面被连续的骨组织覆盖,孔隙中骨小梁增多,纤维及软骨组织明显少于术后3个月。大部分骨组织均包绕在钛合金材料周围,材料与骨基质形成了紧密的结合(图4 E,F)。对照组PEEK材料周围的纤维层厚度虽然较术后3个月有所减少,但仍十分明显,仅少数材料表面可观察到骨组织紧密结合(图4G,H)。
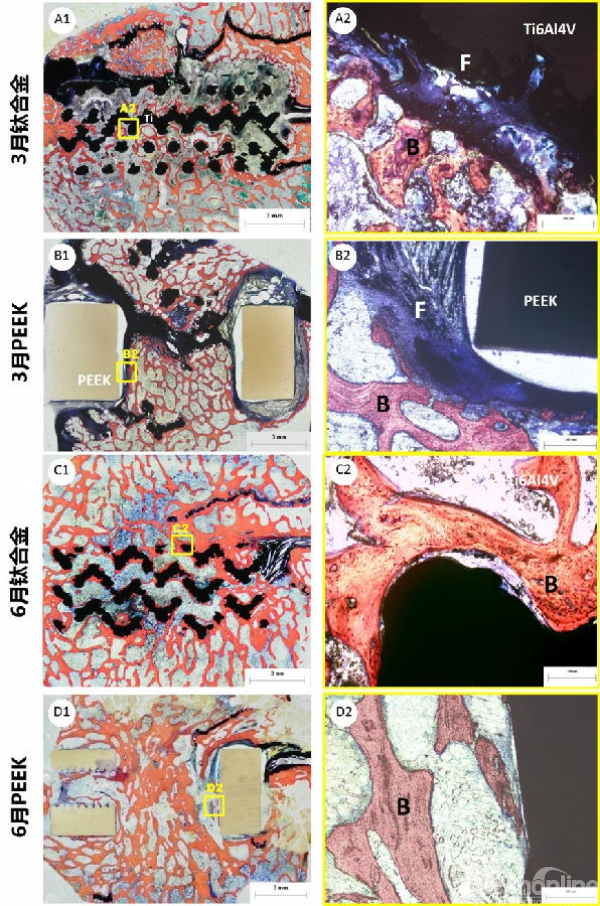
图4 组织学结果:术后3个月,3D打印多孔钛合金孔隙中可见新生骨小梁、纤维与软骨组织(A,B);PEEK材料则完全被纤维组织包绕,纤维层厚度明显大于多孔钛合金材料(C,D);术后6个月,多孔钛合金与骨基质形成了紧密的结合(E,F);PEEK材料周围的包绕的纤维层仍明显可见,骨-材料紧密结合界面少见(G,H);图中“B”为骨组织,“F”为纤维组织,”Ti”为钛合金(Ti-6Al-4V)
双因素方差分析显示实验组与对照组不同节段(C3-4或C4-5)的MBF与BA值的差异均无统计学意义与Micro-CT分析结果一致,组织计量学也显示3D打印多孔钛合金具有较快的骨长入速度从术后3个月的22.2%增加到术后6个月的38.4%,),PEEK融合器中的骨量则保持相对稳定(术后3个月为34.3%,术后6个月为36.3%),术后3个月,两组间比较差异有统计学意义(F=69.085,P=0.000),术后6个月,两组间比较差异无统计学意义(F=1.979,P=0.193,图5), 本实验采用BA值评价材料的骨整合性能,结果提示术后3、6个月3D打印多孔钛合金的BA值均比PEEK材料具有更多的骨-材料紧密结合界面(实验组:术后3个月为10.6%,术后6个月为59.5%;对照组:术后3个月为4.6%,6个月为5.8%),两组间比较差异均有统计学意义(F 3个月=23.052,P3个月=0.001;F 6个月=290.436,P6个月=0.000,图6)。
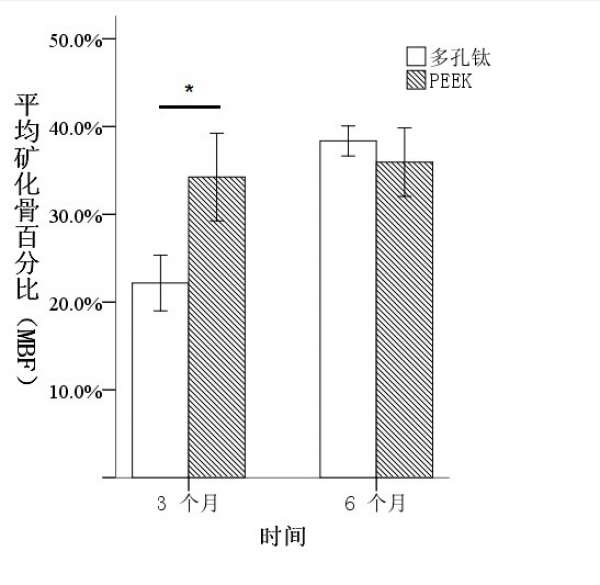
图5 矿化骨百分比MBF(%):3D多孔钛合金孔隙中的矿化骨量随时间增长而增长,并在术后6个月时超过PEEK融合器中央植骨孔处的矿化骨水平,但差异无统计学意义(n=6,*P>0.01)
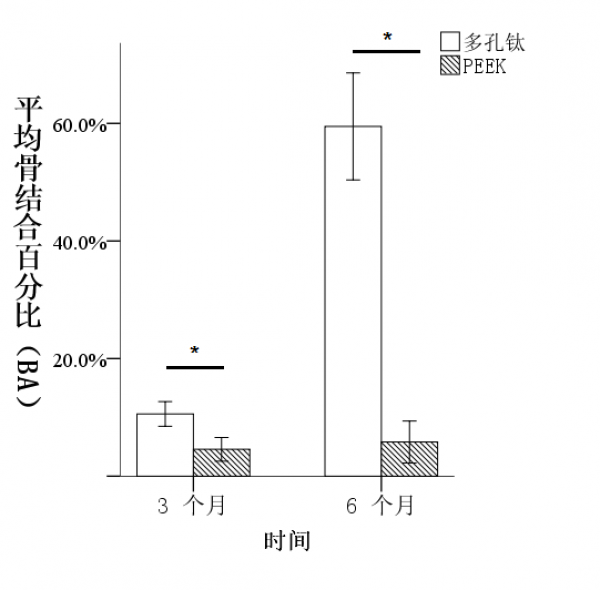
图6 骨-材料结合百分比BA(%):BA值为植入物与骨紧密结合部分占植入物所有内外周长的百分比。3D打印多孔钛合金在两个时间点的BA值均显著高于PEEK材料,显示其更好的骨整合性能。(方差分析,n=6,*P<0.01)
三、生物力学结果
术后6个月,多孔钛合金融合器在旋转、侧弯、屈伸测试中的ROM值(分别为2.45度,3.59度,4.02度)均显著小于PEEK融合器(分别为3.67度,4.64度和4.62度),差异均有统计学意义(F旋转=51.428,P旋转=0.000;F侧弯=16.883,P侧弯=0.003;F屈伸=11.980,P屈伸=0.007,图7),具有更好的力学稳定性。
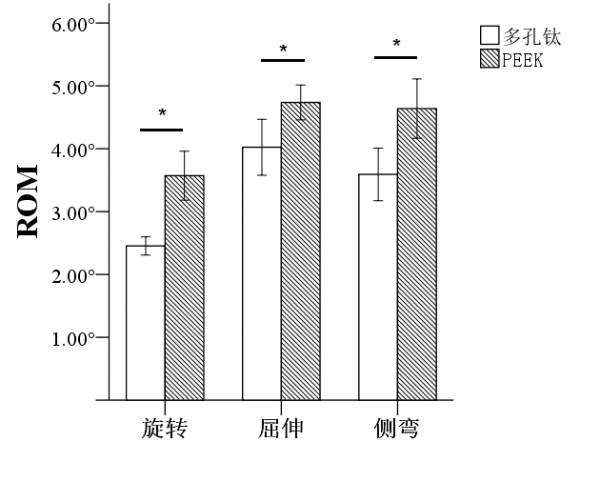
图7 生物力学结果:3D打印多孔钛合金融合器在旋转、侧弯、屈伸测试中的ROM值均显著小于PEEK融合器,具有更好的力学稳定性(n=6,*P<0.01)
讨论
采用融合器进行椎间融合的主要目的在于纠正病变椎体的力学形变并维持力学稳定[13]。而融合节段的长期力学稳定性与融合器的骨整合性能密切相关。
材料的表面特性会显著影响其骨整合性能,近年来的一些离体研究表明钛合金表面可为成骨细胞的黏附及分化提供有利环境。Rapuano等[8]的研究发现钛合金表面自发形成的表面氧化层能够促进细胞外基质蛋白如纤连蛋白,人骨唾液酸糖蛋白等共价或非共价结合到材料表面,从而促进成骨细胞在材料表面的粘附。除此之外,Olivares-Navarrete等[6]的研究也发现与PEEK材料相比,在钛合金表面培养的MG63细胞(人成骨样细胞)具有更高的成骨分化水平,表现在具有更高的碱性磷酸酶活性,更高的骨钙素以及BMP2、BMP4、BMP7表达水平。钛合金的这些表面特性与其良好骨整合性能密切相关。
置入材料的力学性能同样可影响材料的骨整合特性,实体钛合金(Ti-6Al-4V)的弹性模量高达110Gpa,远高于椎体区域骨组织的0.05~30Gpa[14-15]。如此高的弹性模量会在骨-材料界面形成应力遮挡,导致周围骨组织吸收以及纤维组织包绕[16-17]。有研究[12]报道实体钛合金融合器在置入体内6个月后的骨结合的百分比(BA)仍低于10%,骨整合情况并不理想。为解决实体材料所遇到的问题,具有低弹性模量和提供新骨生长孔道等特性的多孔钛合金材料应运而生。然而,传统的粉末冶金压制和浆料发泡等加工工艺由于结构控制困难、复杂形状加工困难和材料各部分力学性能不均匀等缺陷,导致其难以加工出具有理想内部结构和力学特性的多孔钛合金材料,使多孔钛合金的临床应用遇到瓶颈。3D打印技术是新兴的一种快速成型技术,它与传统制造业的最大区别在于产品成型的过程上。由于采用逐层堆积的增量化加工方式,3D打印可以克服一些传统制造上无法达成的设计,量身定制出个性化、精确化并且具有复杂结构的骨科置入产品,从而良好解决多孔钛合金材料的制备难题。
本研究采用3D打印技术制备多孔钛合金椎间融合器,使得钛合金的弹性模量降低为2.5 Gpa,远小于实体钛合金的弹性模量,与骨组织的弹性模量更为接近,极大地减少了应力遮挡效应。组织学观察结果显示术后6个月时约有60%的多孔钛合金小梁表面与骨组织形成了良好的骨整合,远高于PEEK融合器(<6%)。尽管多孔结构也使得钛合金压缩强度降至63MPa,但仍远高于椎体区域松质骨的强度(2~12 Mpa[15]。在本研究中,影像学和组织学分析均未发现材料出现压缩,断裂等现象。
除了良好的表面特性与力学性能外,置入物开放的多孔的结构也可进一步增加融合节段的稳定性。许多学者[18-19]认为,开放的多孔结构允许骨组织长入材料内部,能提供更多的骨-材料结合位点,从而能够增加置入物-骨结合的力学稳定性。因此,虽然本研究中两种融合器在术后6个月均达到了完全融合,但通过融合节段的力学分析我们发现:3D打印多孔钛合金在屈伸、侧弯以及旋转方向上的ROM值均小于PEEK融合器,具有更好的力学稳定性。
组织学分析表明,软骨内成骨机制或许在骨组织长入多孔材料内部的过程中扮演重要角色,这与Assad等[12]的研究相一致,即孔隙中先由纤维、软骨组织填充,随着毛细血管的长入以及氧浓度增高,再逐渐转化为成熟骨组织。在这个过程中,孔隙中的养分及氧浓度对成骨至关重要。为了促进孔隙中的骨长入,必须要采用具有高孔隙率,高孔连通率以及合适孔径的多孔结构[20-21]。以往有文献[22-24]认为,孔径范围在150~1000 μm之间均可观察到骨长入。但Frosch等[24]在最近的一项研究中发现:与小孔径相比(300~500μm),较大的孔径(600μm)可使成骨细胞更快地生长,更容易长入孔隙深部,并且具有更好的成骨分化及基质矿化能力。可能的解释是较大的孔径能够促进孔隙内部的氧分和营养物质交换,减少代谢产物堆积。不仅如此,Kujala等[25]还发现孔径较大的多孔支架(505±136)μm内的纤维组织要少于小孔径支架(259±30) μm。基于以上发现,我们采用了较大的孔径(710±42)μm,并在实验中达到了较快的骨长入速度及较高的骨长入水平(MBF值从术后3个月的22.2%增加到术后6个月的38.4%)。
通过本研究,我们认为3D打印多孔钛合金融合器具有可调的多孔结构,较快的骨长入速度、更好的骨-材料结合界面,且不需要自体植骨,是一种理想的骨科金属置入物,临床应用前景广阔。当然,本研究作为3D打印技术在骨科的初步应用,还有诸多不足,如何进一步完善相关基础研究和展开应用探索来推动3D打印技术向前发展,将成为我们今后努力的方向。
参考文献
[1] Bruner HJ, Guan Y, Yoganandan N, et al.Biomechanics of polyaryletherketone rod composites and titanium rods forposterior lumbosacral instrumentation. Presented at the 2010 Joint SpineSection Meeting. Laboratory investigation[J]. J Neurosurg Spine, 2010, 13(6):766-772.
[2] Chou YC, Chen DC, Hsieh WA, et al. Efficacy ofanterior cervical fusion: comparison of titanium cages, polyetheretherketone(PEEK) cages and autogenous bone grafts[J]. J Clin Neurosci, 2008, 15(11):1240-1245.
[3] Kurtz SM,Devine JN. PEEK biomaterials in trauma, orthopedic, and spinal implants[J].Biomaterials, 2007, 28(32): 4845-4869.
[4] Lied B, Roenning PA, Sundseth J, et al.Anterior cervical discectomy with fusion in patients with cervical discdegeneration: a prospective outcome study of 258 patients (181 fused withautologous bone graft and 77 fused with a PEEK cage) [J]. BMC Surg, 2010, 10:10.
[5] Mastronardi L, Ducati A, Ferrante L. Anteriorcervical fusion with polyetheretherketone (PEEK) cages in the treatment ofdegenerative disc disease. Preliminary observations in 36 consecutive caseswith a minimum 12-month follow-up. Acta Neurochir (Wien) [J]. 2006; 148(3):307-312.
[6] Olivares-Navarrete R, Gittens RA, SchneiderJM, et al. Osteoblasts exhibit a more differentiated phenotype and increasedbone morphogenetic protein production on titanium alloy substrates than onpoly-ether-ether-ketone[J]. Spine J, 2012, 12(3): 265-272.
[7] Santos ER, Goss DG, Morcom RK, et al.Radiologic assessment of interbody fusion using carbon fiber cages[J]. Spine(Phila Pa 1976), 2003, 28(10): 997-1001.
[8] Rapuano BE, Lee JJ, MacDonald DE. Titaniumalloy surface oxide modulates the conformation of adsorbed fibronectin toenhance its binding to α(5) β(1) integrins in osteoblasts[J]. Eur J Oral Sci,2012, 120(3): 185-194.
[9] Sousa SR, Lamghari M, Sampaio P, et al.Osteoblast adhesion and morphology on TiO2 depends on the competitivepreadsorption of albumin and fibronectin[J]. J Biomed Mater Res A, 2008, 84(2):281-290.
[10] Li X, WangC, Zhang W, et al. Fabrication and characterization of porous Ti6Al4V parts forbiomedical applications using electron beam melting process[J]. MaterialsLetters, 2009, 63:403-405.
[11] Ryan G,Pandit A, Apatsidis DP. Fabrication methods of porous metals for use inorthopaedic applications[J]. Biomaterials, 2006, 27(13): 2651-2670.
[12] Assad M,Jarzem P, Leroux MA, et al. Porous titanium-nickel for intervertebral fusion ina sheep model: part 1. Histomorphometric and radiological analysis[J]. J BiomedMater Res B Appl Biomater, 2003, 64(2): 107-120.
[13] Weiner BK,Fraser RD. Spine update lumbar interbody cages[J]. Spine (Phila Pa 1976), 1998,23(5): 634-640.
[14] W. BonfieldMW, K.E. Tanner. Interfaces in analogue biomaterials[J]. Acta Materialia, 1998,46:2509-18.
[15] StamboulisAG, Boccaccini, A.R., Hench, L.L. Novel Biodegradable Polymer/Bioactive GlassComposites for Tissue Engineering Applications[J]. Advanced EngineeringMaterials, 2002, 4:4.
[16] Svehla M,Morberg P, Zicat B, et al. Morphometric and mechanical evaluation of titaniumimplant integration: comparison of five surface structures[J]. J Biomed MaterRes, 2000, 51(1): 15-22.
[17] van Dijk M,Smit TH, Sugihara S, et al. The effect of cage stiffness on the rate of lumbarinterbody fusion: an in vivo model using poly(l-lactic Acid) and titaniumcages[J]. Spine (Phila Pa 1976), 2002, 27(7): 682-688.
[18] Bobyn JD,Stackpool GJ, Hacking SA, et al. Characteristics of bone ingrowth and interfacemechanics of a new porous tantalum biomaterial[J]. J Bone Joint Surg Br, 1999,81(5): 907-914.
[19] Levine BR,Sporer S, Poggie RA, et al. Experimental and clinical performance of poroustantalum in orthopedic surgery[J]. Biomaterials, 2006, 27(27): 4671-4681.
[20] Bai F, WangZ, Lu J, et al. The correlation between the internal structure andvascularization of controllable porous bioceramic materials in vivo: aquantitative study[J]. Tissue Eng Part A, 2010, 16(12): 3791-3803.
[21]Karageorgiou V, Kaplan D. Porosity of 3D biomaterial scaffolds andosteogenesis[J]. Biomaterials, 2005, 26(27): 5474-5491.
[22] Kuboki Y,Jin Q, Takita H. Geometry of carriers controlling phenotypic expression inBMP-induced osteogenesis and chondrogenesis[J]. J Bone Joint Surg Am, 2001,83-A Suppl 1(Pt 2): S105-115.
[23] Turner IG.Ceramics and Glasses Biomedical Materials[M]. Springer US, 2009, 3-39.
[24] Frosch KH,Barvencik F, Viereck V, et al. Growth behavior, matrix production, and geneexpression of human osteoblasts in defined cylindrical titanium channels[J]. JBiomed Mater Res A, 2004, 68(2): 325-334.
[25] Kujala S,Ryhanen J, Danilov A, et al. Effect of porosity on the osteointegration andbone ingrowth of a weight-bearing nickel-titanium bone graft substitute[J].Biomaterials, 2003, 24(25): 4691-4697.





 京公网安备11010502051256号
京公网安备11010502051256号