杨述华:股骨头坏死诊断要点及治疗进展
2014-08-05 文章来源:华中科技大学同济医学院附属协和医院 杨述华 我要说
骨坏死(osteonecrosis, ON)又称无菌性坏死(aseptic necrosis)、无血管性坏死(avascular necrosis)或缺血性坏死(ischemic necrosis),指由于各种原因(机械、生物等)使骨循环中断、骨的活性成分死亡及随后修复的一系列复杂病理过程。骨坏死可累及全身许多关节,以股骨头坏死( osteonecrosis of the femoral head, ONFH)最常见。
美国骨科医师学会(American Academy of Orthopaedic Surgeons, AAOS) 的标准,将ONFH定义为:ONFH是由于股骨头血供中断或受损引起骨细胞及骨髓成分死亡及随后的修复,继而导致股骨头结构改变、股骨头塌陷、关节功能障碍的疾病。
骨坏死已成为一种常见病,据估计美国每年新增患者就有1 万~2 万人,目前对该疾病的认识有了很大的提高,但其发病机理尚未完全明了,对该病治疗的方法很多,但对各种方法的选择及其疗效仍存在争议。骨坏死主要有两种形式,一种是髓内骨坏死,这种骨坏死通常是静止的,仅影响骨髓腔及其骨小梁。另一种同时有髓内骨及皮质骨受累,这种形式的骨坏死常发生在软骨下骨区域,呈进行性发展并伴有骨关节疼痛,最初命名为骨无菌性坏死,此后又称骨缺血性坏死,但因骨坏死发生数周后,部分又出现骨再生,有作者认为骨坏死才应是其标准名称。
一、病因及发病机理
(一) 病因
1. 创伤性骨坏死的病因及发病机理已明确,由于创伤破坏了骨的血供,导致骨发生缺血性坏死,但对于非创伤性骨坏死,对其发病机理争议较大,因而产生了许多理论,包括血栓栓塞理论,即由于血循环内的脂肪、氮气气泡(由于气压病引起)、畸形细胞(镰刀状红细胞)等栓塞了供应骨的血管,骨内压增高理论,小动脉阻塞,静脉阻塞,脉管炎破坏了动脉壁,放射损伤或释放血管因子如Gaucher 病,脂肪代谢紊乱,髓内出血,血管内凝血等。大部分理论不是独立的,而相互关联,不能把骨坏死看作是一个单独的疾病,而应看作是由多种病因引起的一组疾病,通过一共同的途径导致骨坏死和骨机械结构的破坏。近年来研究显示,各种潜在疾病可通过一共同途径―激活血管内凝血引起骨内血管栓塞和骨坏死,激活血管内凝血的潜在因素包括家族性易栓症(蛋白C、蛋白S 或抗凝血酶Ⅲ减少,抗活性蛋白C)、Gaucher’s 病、血红蛋白病、高脂血症和栓塞性脂质、肾上腺皮质功能亢进、酒精中毒、减压病、超敏反应(同种移植器官排斥、过敏性休克、免疫复合物、系统性红斑狼疮、抗磷脂抗体综合症等)、内毒素反应(细菌感染、病毒感染等)、组织因子释放、妊娠、恶肿瘤、神经损伤、感染性肠疾病)、低纤溶作用等。骨的血供由髓内的滋养动脉及骨外来自骨膜和肌肉的血管组成丰富的血管网供应,不同的部位血供情况不一样,在某些部位,如股骨头,侧枝循环较少,在靠近血管主干的远段阻断血管即可导致骨髓、髓内骨及皮质骨的坏死。
2. 血管的阻断血管的阻断可由以下几方面引起:
(1)机械性血管阻断,多由于骨折或脱位,非创伤性的压迫,疲劳骨折等阻断了供应骨血供的血管,若该部分骨血供侧枝循环较少,则引起该部位骨坏死。
(2)血栓形成或血管栓塞,由于血栓形成或脂肪、气泡、异形细胞等栓塞了供应骨的血管。
(3)损伤或压迫血管壁,由于脉管炎、放射损伤、急性血管痉挛等引起血管壁暂时或永久性损害,导致骨血供消失,出现骨坏死。同样如果骨内的压力由于血液外渗、脂肪或细胞等原因导致增高,阻塞了血供,也会出现骨缺血或坏死。
(4)静脉阻塞,在一个封闭的系统里,如果静脉压超过了动脉压,将损害动脉血供,随后的缺血引起骨坏死。如在股骨头,血管大部分通过关节囊下的组织,若关节内积液,静脉压增高,影响动脉血供并导致骨坏死。
(二)股骨头坏死分类
1. 创伤性骨坏死
2. 无菌性骨坏死
3. 非创伤性骨坏死
4. 压缩或疲劳骨折
5. 酒精中毒
6. 气压病
7. 结缔组织疾病(类风湿关节炎或系统性红斑狼疮)
8. 脉管炎
9. 血红蛋白病
10. 凝血病
11. 放射损伤
12. 应用激素
13. 与年龄有关的股骨远端损伤
14. 怀孕
15. 痛风
16. 胰腺炎
17. 特发性或自发性骨坏死
18. 儿童疾病(Legg-Calvé-Perthes 病,Sever’s 病,Köhler’s 病, Larsen’s 病,Blount’s 病, Panner’s 病)
三、病理
尽管骨坏死病因及发病机理各异,但病理变化却基本相同。当髓内骨梗塞发生坏死,导致细胞坏死、骨组织酸化及溶酶体释放,释放的钙与骨髓脂肪细胞释放的游离脂肪酸结合形成不溶解的脂肪酸钙盐,机体没有特殊的酶溶解梗死的组织,因而可在体内长期存留,临床上表现为静止状态,不进一步发展。若在股骨头、膝关节、肩关节等部位发生皮质网状骨坏死,梗塞坏死区域进一步扩大,髓内骨、骨髓及皮质骨均坏死,在早期邻近骨组织显示充血,毛细血管及成纤维细胞增生等修复反应。数周后血管自周围修复组织长入坏死骨组织,一方面带入破骨细胞吸收坏死骨,另一方面由成骨细胞形成新骨覆盖在坏死骨表面,因而在X线片上表现为骨密度增加。随着修复反应的进一步发展,骨组织的完整性遭到破坏,出现骨小梁骨折,导致软骨塌陷,股骨头、肱骨头或股骨髁等变形。
四、诊断、鉴别诊断
骨坏死的临床症状因发生部位及坏死大小而异,髓内骨坏死大部分是静止的,无临床症状,手足部位的小骨坏死多有症状,但对功能影响较小,老年妇女股骨内髁坏死常症状较重,但并不常见,双侧肩关节的骨坏死常常导致关节功能障碍,但最为常见而且致残最严重的是股骨头坏死。疼痛常常是骨坏死的主要症状,通常是慢性隐痛,在某些情况下症状可较重,如在Gaucher’s 病、气压病、血红蛋白病发生较大的梗死灶。疼痛可随关节活动逐步增重,最后发展至休息时也疼痛,常需要服用药物才能缓解。受累关节常有活动受限,有时局部有压痛,如果在下肢,可有跛行。如怀疑骨坏死,须进一步做特殊检查,包括X 线片、CT、MRI、放射性核素骨扫描、髓内压测定、组织活检等。
股骨头坏死诊断标准: 专家建议综合日本厚生省骨坏死研究会(JlC)和Mont提出的诊断标准,制定我国的诊断标准。
(一) 主要标准
1.临床症状、体征和病史:以腹股沟和臀部、大腿部位为主髋关节痛,髋关节内旋活动受限,有髋部外伤史、皮质类固醇应用史、酗酒史。
2.x 线片改变:股骨头塌陷,不伴关节间隙变窄:股骨头内有分界的硬化带:软骨下骨有透x线带(新月征,软骨下骨折)。
3.核素扫描示股骨头内热区中有冷区。
4.股骨头MRl的T1加权相呈带状低信号(带状类型)或T2加权相有双线征。
5.骨活检显示骨小梁的骨细胞空陷窝多于50% 且累及邻近多根骨小梁, 有骨髓坏死。
(二)次要标准
1.x线片示股骨头塌陷伴关节间隙变窄,股骨头内有囊性变或斑点状硬化,股骨头外上部诊断标准
2.核素骨扫描示冷区或热区。
3.MRl示等质或异质低信号强度而无T1相的带状类型。符合两条或两条以上主要标准可确诊。
符合一条主要标准,或次要标准阳性数≥4(至少包括一种x线片阳性改变),则为可能诊断。
(三) 体征
1. 主要体征X 线表现股骨头塌陷,股骨头内有硬化带(分界线),软骨下有新月征,无关节间隙狭窄,髋臼无异常见(图1)。
2. 次要体征X 线表现,伴随关节间隙狭窄的股骨头塌陷,股骨头内呈半透明影或半透明与硬化混合存在的囊性变,股骨头负重区变扁。

图1 X 线表现股骨头内有硬化带,软骨下有新月征
(四)临床症状站立或行走时髋关节或大腿疼痛,有激素治疗或嗜酒史。
骨闪烁成像显示热区中的冷区,组织活检证实骨坏死,骨闪烁显像显示热区或冷区损害,MRI显示股骨头内低信号点见(图2)。
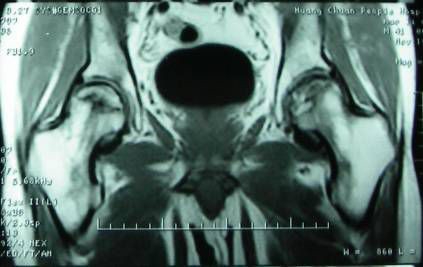
(图2)MRI 显示股骨头内低信号点双侧股骨头坏死
(五)鉴别诊断对具有类似的x线改变或MRl改变的病变, 应注意鉴别。
1.中、晚期骨关节炎:当关节间隙轻度变窄,出现软骨下囊性变时可能会混淆,但其CT表现为硬化并有囊变,MRl改变以低信号为主, 可据此鉴别。
2.髋臼发育不良继发骨关节炎:股骨头包裹不全, 髋臼线在股骨头外上部,关节间隙变窄、消失,骨硬化、囊变,髋臼对应区出现类似改变,与ON F H 容易鉴别。
3.强直性脊柱炎累及髋关节:常见于青少年男性,多为双侧骶髂关节受累,其特点为HLA—B27阳性,股骨头保持圆形,但关节间隙变窄、消失甚至融合, 故不难鉴别。部分患者长期应用皮质类固醇可合并ONFH,股骨头可出现塌陷但往往不严重。
4.类风湿关节炎:多见于女性。常见股骨头关节面及髋臼骨侵蚀,鉴别不难。
(六)具有类似MRl改变疾病的鉴别诊断
1.暂时性骨质疏松症(1TOH):可见于中年男女性患者,属暂时性疼痛性骨髓水肿。x 线片示股骨头、颈甚至转子部骨量减少。MRl可见T1加权相均匀低信号,T2加权相高信号,范围可至股骨颈及转子部, 无带状低信号, 可与ONFH鉴别。此病可在3~6个月内自愈。
2.软骨下不全骨折:多见于60岁以上老年患者,无明显外伤史,表现为突然发作的髋部疼痛,不能行走,关节活动受限。x线片示股骨头外上部稍变扁,MRl的T1及T2 加权相显示软骨下低信号线,周围骨髓水肿,T2抑脂相显示片状高信号。
3.色素沉着绒毛结节性滑膜炎:多发于膝关节,髋关节受累少见。累及髋关节的特点为:青少年发病,髋部轻中度痛伴有跛行,早、中期关节活动轻度受限。CT及x线摄片可显示股骨头、颈或髋臼皮质骨侵蚀,关节间隙轻、中度变窄。MRl示广泛滑膜肥厚,低或中度信号均匀分布。
4.股骨头挫伤:多见于中年有髋关节外伤史患者,表现为髋部痛及跛行。MRl示位于股骨头内的T1加权相中等强度信号、T2加权相高信号, 内侧较多。
5.滑膜疝洼(synovial he rnia—tion pit):此为滑膜组织增生侵入股骨颈部皮质的良性病变,M Rl示T1加权相低信号、T2加权相高信号的小型圆形病灶,多侵蚀股骨颈上部皮质,通常无症状。对具有类似的x线改变或MRl改变的病变, 应注意鉴别。
五、股骨头坏死分期
股骨头坏死分期
(一) Ficat 分期
Ⅰ期X 线表现正常。
Ⅱ期股骨头外形正常,但有明显的骨修复表现,包括囊性变及骨硬化。在X 线片上看到的放射透亮区在组织学上表现为骨吸收区及相应的纤维组织或肉芽组织。骨硬化区在组织学上表现为坏死区边缘新骨覆盖于死骨上。
Ⅲ期有软骨下骨塌陷或股骨头变扁。
Ⅳ期,股骨头变形明显,关节间隙变窄。
㈡Steinberg 分期(表1)
表1 股骨头坏死Steinberg 分期





VI 严重退行性变
(三) ARCO将股骨头坏死分为6期:
0期, X线片、MRI、ECT检查均正常,只有在取出股骨头内坏死组织进行病理学检查时才能发现骨坏死。
1期, X线片正常,MR I和同位素检查( ECT)影像可发现异常,股骨头外形正常。此期股骨头形态无改变,在股骨头切面上坏死灶与正常活骨有明确分界,分界处破骨细胞活动增加,增生的成纤维细胞和毛细血管在骨小梁间浸润。
2期, X线片、MRI和ECT均可发现异常,在骨坏死区周围可见X线致密带将坏死区与临近存活的骨组织分隔,股骨头外形正常。此期股骨头形态仍无改变,切面上坏死灶的边界更加清晰呈带状(X线致密带),此致密带由增厚的骨小梁和骨小梁间隙钙化组织混合构成。在坏死灶内骨髓被无血管纤维组织替代,后者可见程度不同的无定形颗粒钙化,此区域内无纤维血管组织和相应形成的新骨,到此期宣告人体对坏死骨的
修复失败。
3期, X线片显示股骨头有塌陷,半月征出现,股骨头外形基本正常。
4期, X线片显示股骨头外形明显改变,塌陷变平,关节间隙存在。
5期, 股骨头变形明显,关节间隙变窄。
六、股骨头坏死的治疗
(一) 非手术治疗
1.避免负重包括部分负重及完全不负重,仅应用于塌陷前的股骨头坏死,即FicatⅠ期及Ⅱ期,从文献报道看,单纯采取避免负重的治疗方法效果并不理想,成功率低于15%,而对于病变位于股骨头内侧的A 型股骨头坏死可考虑应用这一方法,文献报道采用这一治疗
方法的22 例A 型股骨头坏死,仅有2 例发生股骨头塌陷(占9%)。
2.药物治疗应用药物治疗股骨头坏死的报道较少,只适用于早期病例,应用药物包括氢化麦角碱、长春胺、心痛定等,尚有一些血管活性药物及降脂药物正在试验中,康力龙能增强纤维蛋白溶解作用,可缓解髋关节疼痛。总之药物治疗效果尚不能肯定,但因其无创性,是一个重要的研究方向。
3.电刺激治疗鉴于电刺激可促进骨再生及新血管形成,部分作者报道了利用电刺激治疗股骨头缺血性坏死,方法包括非侵入性的电磁场刺激、中心减压后插入电极进行直流电刺激、中心减压后进行非侵入性直流电刺激。这一方法实验研究取得了较好的效果,但并未
在临床上推广应用,对于最佳电量、用法及治疗时间尚有待于进一步研究。
4.其他治疗方法如介入疗法、高压氧治疗等,效果有待进一步确定。
㈡手术治疗
1.中心减压中心减压治疗股骨头坏死的理论依据是骨坏死骨内压增高理论,通过中心减压可降低骨内压,增加股骨头内血流,而且中心减压可刺激减压隧道内的血管生长促进坏死骨的爬行替代。有关中心减压的文章较多,对其疗效争议较大,其疗效与股骨头坏死分
期有很大的关系,而与股骨头坏死的病因关系不大,目前认为这一方法主要适用于FicatⅠ期、Ⅱ期而且病变范围低于30%,对于病变范围较大的Ⅰ期、Ⅱ期及Ⅲ期、Ⅳ期效果不太理想,若由于种种原因不能做更大的手术时,可应用中心减压作为一种姑息性疗法,减轻疼痛。
2.截骨术截骨术的目的是改变股骨头主要负重区,将正常骨代替坏死骨成为主要负重区。这一方法包括经转子旋转截骨、转子间内翻截骨及转子间外翻截骨,也可结合植骨术治疗,主要适用于FicatⅡ期及Ⅲ期且病变范围较小的病人。
3.植骨术植骨术包括自体松质骨移植、自体皮质骨移植、异体骨移植、软骨移植,可结合中心减压、电刺激、截骨术等其他治疗方法。其中自体松质骨及皮质骨移植应用较多,自体松质骨具有良好的诱导成骨作用,可促进坏死股骨头的修复,皮质骨在股骨头修复过程中对坏死区域的关节软骨及软骨下骨起支撑作用。
4.带血供的骨移植带血供的骨移植方法较多,移植骨可来自髂骨、大转子或腓骨,可带肌蒂或带血管蒂,带血供的骨移植与普通的骨移植比较可增加股骨头血供,加速骨愈合。带血供的骨移植可应用于FicatⅡ期。
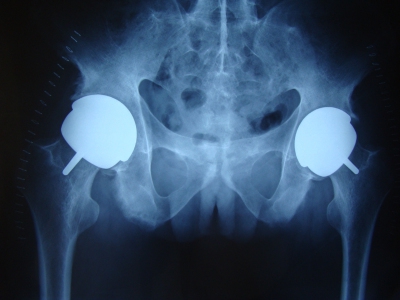
5.支撑架植入术近一个世纪以来,临床医生采用髓内减压加植骨、血管植入、带肌瓣或带血管骨瓣移植等方法试图重建股骨头的血运,但均因股骨头内缺乏有力的支撑而无法阻止股骨头的进一步塌陷。杨述华等[13,14]为防止股骨头塌陷,为坏死股骨头软骨下骨板提供足够的力学支撑,设计了呈圆柱状中空带螺纹同种异体骨支撑架,通过髓芯减压隧道植入到坏死区软骨下骨板下,防止股骨头塌陷,同时将自体松质骨和DBM放入支撑架内,治疗早期股骨头坏死,取得满意效果,为股骨头的治疗提供了一种崭新的思路(图3)
(图3)圆柱状中空带螺纹同种异体骨支撑架植入
6. 多孔钽金属植入多孔钽材料的结构、作用、与弹性都很像天然骨。这种植入物有非常多的小孔,非常接近骨海绵。因此,提供了骨生长时一个畅通的通道。多孔钽材料是含有互联孔的生物材料,具有75-80%高孔隙率。其骨内生长能力高出传统多孔涂层材料2至3倍,而表面剪切抵抗力是其2 倍。钽金属使用蒸汽沉积技术成型,从而得到与松质骨类似的蜂窝状立体结构,其晶体微结构有利于骨的直接敷着。钽元素具有良好的强度和耐蚀性,同时有很好的生物相容性。这些特点使得钽材料在如颅骨成形术和起搏器引导等外科手术中应用超过50 年。多孔钽有高的强度重量比,使之有承受生理负重的机械特性,其抗压强度和弹性模量与其他负重假体材料相比更接近骨,其硬度使其易于传导生理负重,而使应力屏障最小化。同时,与骨的高摩擦系数确保假体初始稳定性。多孔钽类似骨的生理和机械特性使其得到广泛的骨内生长。经皮植入物的动物研究显示新生骨迅速浸润其孔隙。术后8 周,骨已生长并填充多孔空间的大部分。孔的大小和容积使
血管和软组织快速安全的生长(图4)。

(图4)多孔钽金属植入
7.全髋关节表面置换术自Smith-Petersen首次采用股骨头金属单杯假体治疗髋关节疾患以来,表面髋关节置换技术发展至今已有60年历史。现代全髋关节表面置换假体的特点:
(1) 高碳钴铬钼合金的金属对金属假体。
(2) 髋臼均为压配, 表面为多孔或羟基磷灰石喷涂,股骨头帽采用短细柄保持位置,
股骨头假体骨水泥固定。
(3) 较大直径的球头假体、降低脱位率。
(4) 合适的接触摩擦,减小磨损。
比较传统的全髋关节置换而言,表面置换有其显著优势:
(1) 较完整的重建了髋关节的解剖结构,最大限度的保留了髋关节骨质,为以后的全髋翻修术提供了良好的基础,翻修手术难度降低。
(2) 较大的假体直径降低了髋关节脱位的风险。
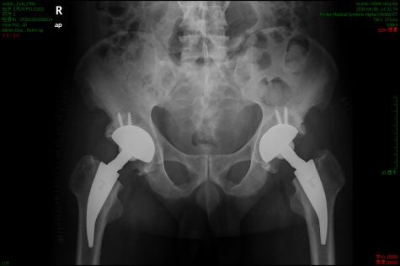
(3) 股骨上的力学传导接近生理状态,它能最大限度保留本体感觉有利于年轻活动量大的患者,Danie等在446 例髋关节表面置换的患者随访中发现,90%患者术后恢复体育活动,术后2~8 年的随访中仅有1例进行了翻修见(图5)。
(图5)全髋关节表面置换术
8.Metha 短柄关节置换术
Metha 短柄人工髋关节是一种全新的髋关节假体,它的设计理念来源于Bernard 等在80年代中期提出的“三点支撑”理论。相比传统的人工关节假体,短柄髋关节假体更适于年轻活动量大、髋关节功能要求高的患者,其有如下优势与特点:
(1) 更小的手术切口,宜为患者所接受。
(2) 截骨量少、更多的保留股骨颈骨质,提供更好的正常生理负载。
17
(3) 肌肉软组织损伤小,关节功能恢复快。
(4) 更符合生物力学原理
(5) 应用非骨水泥假体。
(6) 多种不同角度可选的假体颈模块,更方便前倾角的调节。
(7) 为以后的全髋翻修提供了良好的基础,翻修手术难度降低。
其适应症有:原发性髋关节骨性关节炎,创伤性髋关节骨性关节炎,类风湿性髋关节炎,perthes 病,股骨头坏死,股骨头骺滑脱症。该项技术适应症必须严格控制,对于骨质疏松症,髋关节发育不良,股骨颈畸形和有过敏体质的患者需慎重选择。(图6)
(图6)双侧短柄关节置换术一例
9.髋关节置换术对于晚期FicatⅢ期或Ⅳ期病人,全髋置换术是最佳选择,全髋假体有骨水泥固定型及非骨水泥固定型两种,两种假体各有优缺点,长期结果是相似的。早年骨水泥假体由于有较高的假体周围骨溶解和无菌松动而使这一型假体一度受到质疑,但随着现代骨水泥技术的应用,假体松动率明显降低,尤其是骨水泥型股骨柄假体取得了令人满意的效果,使骨水泥假体又流行起来,但骨水泥型髋臼假体的松动率仍然较高。非骨水泥型假体自80 年代开始逐步受到重视,但存在早期假体微动和下沉问题,术后跛行及大腿痛发生率高,而非骨水泥型髋臼假体取得了很好的早期临床效果。非骨水泥型假体主要用于年轻、骨质条件好或返修术病人,而骨水泥型假体主要用于老年、骨质疏松患者。由于骨水泥股骨柄假体术后效果优于非骨水泥型,而非骨水泥型髋臼假体又优于骨水泥型,近年来选用骨水泥型股骨柄假体与非骨水泥型髋臼的杂交式固定逐步流行起来。对于股骨头坏死无论采用骨水泥型或非骨水泥型假体,其效果均较其他疾病差,其原因包括:1)、由于激素诱导的骨坏死病人相对较年轻、活动较多,而且双侧股骨头坏死的发病率较高。2)、激素可抑制骨形成,刺激骨吸收。这类病人在术后继续使用激素易产生假体松动。3)、这类病人容易导致植入较实际偏小的假体,如在植入非骨水泥假体时,由于曾行骨移植影响扩髓,导致植入偏小的假体,被迫在内翻位植入出现早期疼痛及松动,使得手术失败。股骨头坏死行单极或双极股骨头假体半髋置换由于存在髋臼软骨进行性磨损及假体松动、而且侵及骨髓腔不利于返修已被摒弃。由于股骨头坏死患者相对较年轻,全髋关节置换后最终仍需行返修术,有人主张对于FicatⅢ期髋臼较完整而且较年轻的病人行股骨头表面置换术,由于这一方法保留了完整的骨床,很容易进行返修术,可推迟行全髋置换术,因而是一种很好的过度性疗法。
总之,股骨头坏死的治疗方法很多,各种治疗方法的效果很大程度上取决于骨坏死的分期、骨坏死的部位及范围、致病因素是否继续存在。股骨头坏死的治疗可分为可逆阶段及不可逆阶段,早期诊断,在其可逆阶段进行治疗可望逆转病变的发展,中心减压对早期股骨头
坏死的治疗效果已得到大部分作者承认,结合骨移植、电刺激等措施可提高其疗效,一旦骨坏死进入不可逆阶段,则各种治疗方法均不太理想,只能是延缓病程的发展,其最终结局是股骨头塌陷并继发骨性关节炎。对于出现骨性关节炎的病人,关节置换只能是最佳选择,但
由于此类病人关节置换效果较其他病人差,因此在出现骨性关节炎前,采取各种保存股骨头的治疗方法延缓病程的发展,推迟全髋置换的时间仍属必要。
参考文献
1. Aaron RK, Ciombar DM, Jolly G et al. Stimulation of experimental endochondralossification by loww-energy pulsing electromagnetic field. J Bone and Min Res.1989, 4:227-233.
2. Arlet J. Nontraumatic avascular necrosis of the femoral head. Past, present and future. Clin Orthop. 1992, 277:12-21.
3. Atsumi T, Kuroki Y. Role of impairment of blood supply of the femoral head in the pathogenesis of idiopathic osteonecrosis. Clin Orthop. 1992, 277:22-30.
4. Buckly PD, Gearen PF. Structural bone-grafting for early atraumatic avascular necrosis of the femoral head. J Bone Joint Surg[Am]. 1991, 73:1357-64.
5. Collaborative osteonscrosis group. Symptomatic multifocal osteonecrosis. ClinOrthop. 1999, 369:312-326.
6. Cruess RL. Osteonecrosis of bone: current concepts as to etiology and pathogenesis. Clin Orthop. 1986, 208:30-9.
7. Cushner MA, Friedman RJ. Osteonecrosis of the Humeral Head. J Am Acad Orthop Surg. 1997, Nov;5(6):339-346
8. Dean MT, Cambanela ME. Transtrochanteric anterior rotational osteotomy foravascular necrosis of the femoral head. Long-term result. J Bone Joint Surg[Br].1993, 75:597-601.
9. Desforges JF. Nontraumatic necrosis of bone. New Eng J Med, 1992,326(22):1473-79.
10. Ecker ML, Lotke PA. Spontaneous Osteonecrosis of the Knee. J Am Acad Orthop Surg.1994, May;2(3):173-178.
11. Fraibank-AC, Jinnah RH, Hungerford DS et al. Long-term results of coredecompression for ischemic necrosis of the femoral head. J Bone JiontSurg(Br). 1995;77(1):42-49.
12. Ficat RP. Arlet J. Ischemia and Necrosis of Bone Baltimor:Willians and Wilkins, 1980;36-42.
13. Garino JP, Steinberg ME. Total hip arthroplasty in patient with avascular necrosis of the femoral head. Clin Orthop. 1997, 334:108-115.
14. Glueck CJ, Freiberg R, Glueck HI et al. Hypofibrinolysis: a common, major cause of osteonecrosis. Am J Hematol. 1994, 45:156-166.
15. Hattrup SJ, Cofield RH. Osteonecrosis of the humeral head: relationship of disease stage, extent, and cause to natural history. J Shoulder Elbow Surg. 1999, Nov-Dec;8(6):559-64.
16. Hungerford DS, Lennox DW. Ischemic Necrosis of the femoral head. In Surgery of the musculoskeletal system. edit by C. McC Erarts.Ed.2.New York:Churchill Livingstone. 1990;vol3.2757-2794.
17. Iwata H, Torii S, Hasegawa Y et al. Indications and results of vascularized pedicle iliac bone graft in avascular necrosis of the femoral head. Clin Orthop. 1993, 295:281-288.
18. Jacobs MA, Hungerford DS, Krackow KA. Intertrochanteric osteotomy for avascular necrosis of the femoral head. J Bone Jiont Surg(Br), 1989, 71(2):200-204.
19. Jacques HP, Glueck CJ, Ohio C, et al. Familial heterozygous protein-S
deficiency in a patien who had multifocal osteonecrosis. J Bone Jiont Surg(Am), 1997, 79(7):1097-1084.
20. Jergeson HE, Khan AS. The natueral history of untreated asymptomatichipsin patient who have non-traumatic osteonecrosis. J Bone Jiont Surg(Am), 1997, 79(3):359-363.
21. Jones JP. Fat embolism, intravascular coagulation, and osteonecrosis.Clin Orthop. 1991, 292:294-308.
22. Jones JP. Intravascular coagulation and osteonecrosis. Clin Orthop. 1992,277:41-53.
23. Katz RL, Bourne RB, Rorabeck CH, et al. Total hip arthroplasty in patient with avascular necrosis of the hip. Follow-up observation on cementless and cemented operations. Clin Orthop. 1994, 281:145-151.
24. Kokubo KA, Takatori Y, Ninomiya T, et al. Magnetic resonance imaging and scintigraphy of avascular necrosis of the femoral head. Predication of subsequent segimental collapse. Clin Orthop. 1992, 277:54-60.
25. Learmonth ID, Maloon S, Dall G. Core decompression for early atraumatic osteonecrosis of the femoral head. J Bone Joint Surg (Br),1990;72(3):387-390.
26. Lihs RE, Barnes BC, Callaghan JJ, et al. Evaluation of uncemented total hip arthroplasty in patients with avascular necrosis of the femoral head. Clin Orthop.1993, 297:168-173.
27. Mann RA, Van Manen JW, Wapner K, et al. Ankle fusion. Clin Orthop. 1991,268:49-55.
28. Mont MA, Hungerford DS. Non-traumatic avascular necrosis of the femoral head.J Bone Joint Surg[Am]. 1995, 77(3):459-474.
29. Mont MA, Myers TH, Krackow KA, et al. Total knee arthroplasty for osteonecrosis.Clin Orthop. 1997, 334:91-97.
30. Mont MA, Schon LC, Hungerford MW, et al. Avascular necrosis of the talus treated by core decompression. J Bone Joint Surg[Br]. 1996, 78:827-830.
31. Mont MA, Tomek IM, Hungerford DS. Core decompression for avascular necrosis of the distal femur: Long-term follow-up. Clin Orthop. 1997, 334:124-130.
32. Ohzono K, Saito M, Sugano N, et al. The fate of nontraumatic avascular necrosis of the femoral head. A radiologic classification to formulate prognosis. ClinOrthop. 1992, 277:73-78.
33. Ohzono K, Takaoka K, Saito M, et al. Intraosseous arterial architecture in nontraumatic avascular necrosis of the femoral head. Microangiographic and histologic study. Clin Orthop. 1992, 277:79-88.
34. Ohzono K, Saito M, Takaoka K, et al. Natural history of nontraumatic avascular necrosis of the femoral head. J Bone Joint Surg[Br]. 1991, 73(1):68-72.
35. Scranton PE. An overview of ankle arthrodesis. Clin Orthop. 1991, 268:96-101.
36. Stulberg BN, Singer R, Goldner J, et al. Uncemented total hip arthroplasty in osteonecrosis. A 2 to 10 year evaluation. Clin Orthop. 1997. 334:116-123.
37. Sugano N, Takaoka K, Ohzono K, et al. Prognostication of nontraumatic avascular necrosis of the femoral head. Clin Orthop. 1993, 303:155-164.
38. Wang GJ, Cui Q, Balian G et al. The pathogenesis and prevention of steroid induced osteonecrosis. Clin Orthop. 2000, 370:295-310.
39. Yamamoto T, Harino K, Tsutsui H,et al,Coticosteroid enhance the experimental induction of osteonecrosis in rabbits with Shwartsman reaction.Clin Orthop. 1995,316:235~243
40. Shuhua Yang, Xinghuo Wu, Cao Yang, Jin Li, Weihua Xu, Shunan Ye. Structural Augmentation with Biomaterial Loaded Allograft Threaded Cage for the Treatment of Femoral Head Osteonecrosis. Surgical technique. (Journal of orthopaedic science, )
41. Xinghuo Wu, Shuhua Yang,et al. Experimental osteonecrosis induced by a combination of low-dose lipopolysaccharide and high-dose methylprednisolone in
rabbits.Joint Bone Spine.
42. 杨述华,吴星火,杨操,等.异体骨笼结合脱钙骨基质和自体骨植入治疗股骨头坏死的临床观察.中华关节外科杂志(电子版),2008, 2 (1):7-10:
43. 杨述华. 空心钛支撑架结合自体骨移植治疗股骨头坏死. 临床骨科杂志,2005;8(4):289-291..
44. 杨述华,吴星火,杨操,等.异体骨笼结合脱钙骨基质和自体骨植入治疗股骨头坏死的临床观察.中华关节外科杂志(电子版),2008, 2 (1):7-10:
45. 杨述华.强化力学结构空心骨螺钉结合自体骨移植治疗股骨头坏死.中华骨科杂志,2006;(26)5:313-315
46. Shuhua Yang, MD, Xinghuo Wu, MD, Weihua Xu, MD, Structural Augmentation with Biomaterial-Loaded Allograft Threaded Cage for the Treatment of Femoral Head Osteonecrosis. The Journal of Arthroplasty Vol. 00 No. 0 2009;1-7





 京公网安备11010502051256号
京公网安备11010502051256号