-

-
赵希君 #1详尽,其实,愿华西的诸位老师多发
全髋关节置换术后髋周炎性假瘤的诊断和治疗
2014-05-20 文章来源:四川大学华西医院骨科 康鹏德 裴福兴 沈彬 周宗科 杨静 我要说
摘要:目的 回顾性分析金属-聚乙烯负重界面全髋关节置换(total hip arthroplasty, THA)术后骨盆内、髋周炎性假瘤及其外科治疗。 材料与方法 2006年3月至2011年6月,共7例(7髋)初次金属-高分子聚乙烯非骨水泥THA术后假体周围局灶性骨溶解患者,经X线片和(或)三维CT扫描、超声检查,明确炎性假瘤,其中男2例,女5例,年龄32—65岁,平均48.8岁,假体均稳定固定。7例患者均存在聚乙烯不对称磨损,髋臼DeleeⅡ区(6髋)和股骨GruenⅡ区局灶性骨溶解。患者行炎性假瘤包块切除、清除骨溶解病灶、同种异体颗粒骨植骨并更换负重界面(陶瓷-高交联聚乙烯)术。术后定期随访,观察有无炎性假瘤复发及假体周围骨溶解发生,以及感染、深静脉血栓形成、脱位等并发症发生。并对患髋进行Harris评分。 结果 7例患者均获得随访时间3-42个月(平均30个月)随访。随访期间无局部炎性假瘤复发,无假体周围新发骨溶解及假体松动。4髋假体周围骨溶解区完全被骨组织替代,2髋有较好的骨长入。末次随访时Harris评分86-100分,平均92.4分。无假体周围感染、异位固化以及假体周围骨折、深静脉血栓形成、脱位等并发症发生。无1例患者因各种原因导致失败而再次翻修。 结论 初次THA术后聚乙烯磨损可诱发骨盆内、髋部产生炎性假瘤及假体周围局灶性骨溶解;手术切除炎性假瘤、清除骨溶解病灶并植骨,更换负重界面可以有效地保留稳定固定的假体,避免假体松动。
关键词:全髋关节置换;聚乙烯;炎性假瘤;骨溶解;外科,治疗
髋臼聚乙烯内衬磨损、磨损产生的聚乙烯颗粒诱发假体周围骨溶解是聚乙烯负重界面全髋关节置换(total hip arthroplasty, THA)术后并发症之一,也是导致THA术后翻修的主要原因之一[1-3]。磨损的聚乙烯颗粒随关节液弥散至假体周围,被多核巨噬细胞吞噬,产生相关炎性介质而诱发局部产生慢性炎性反应,进而激活破骨细胞,导致假体周围发生骨溶解、假体松动[4],大量的聚乙烯磨损颗粒在假体周围或髋周聚集,刺激局部发生慢性炎性反应,形成肉芽肿样包块,称之为“炎性假瘤”(pseudotumor)[5-9]。炎性假瘤常发生于聚乙烯负重界面或金属-金属负重界面THA术后[5-9]。我们曾报道了金属-高分子聚乙烯负重界面THA后聚乙烯磨损、髋臼周围局灶性骨溶解保留髋臼假体治疗的外科治疗[10]。期间部分病例伴随有髋周(骨盆内、股骨大腿)出现炎性假瘤同期行假瘤清除或切除治疗。本文回顾性分析我院2006年3月至2011年6月期间收治THA术后假体周围骨溶解伴炎性假瘤病例。
材料与方法
一、一般资料
2006年3月至2011年6月,我院共收治初次THA术后假体周围骨溶解伴炎性假瘤形成患者7例(7髋),男2例,女5例,7例患者假体均稳定固定;患者年龄32—65岁,平均48.8岁。初次接受THA手术的原因为髋关节发育不良继发骨关节炎3例,股骨头坏死2例,髋关节化脓性关节炎治愈后继发骨关节炎1例,股骨颈骨折内固定术后股骨头坏死1例。
初次THA时7例患者所用假体均为Duraloc 100非骨水泥臼杯(Depuy,美国),高分子聚乙烯内衬(常规射线空气中消毒,照射剂量25-39kGy)厚度10-16mm,平均12.8mm;28mm钴铬钼金属头,非骨水泥柄4例,骨水泥柄3例。
7例患者术前均摄骨盆正位、髋关节正侧位X线片观察假体周围透光线、假体位置、聚乙烯磨损,如发现异常则摄骨盆闭孔斜位和髂斜位X线片和(或)三维CT扫描。并超声检查,确定包块位置、大小、性质。并血清学指标检查,包括白细胞计数及分类,血沉(ESR)、C反应蛋白(CRP)。
二、炎性假瘤及骨溶解诊断
炎性假瘤为THA术后假体周围或骨盆髂窝内出现炎性包块,包块可出现疼痛,也可无痛,同时排除肿瘤和感染[5-9]。骨溶解定义为初次THA手术至少6-12周后X线片上出现假体周围无骨小梁的低密度透光区/线,且通过髋臼臼杯顶部孔与关节腔相通[11,12]。髋臼周围骨溶解区在正位X线片上按DeLee和Charnley法[13]分区确定。聚乙烯内衬线性磨损距离(linear wear,mm)采用Canvas 6.0软件(Deneba Systems, Scientific Imagine Edition,美国)测量[14]。股骨侧骨溶解区按Gruen分区。
4例因发现腹股沟、或髂窝处渐大、隐痛不适包块而就诊;1例因大腿上外侧出现渐增大无痛性包块就诊;2例术后定期随访拍片发现假体周围局灶性骨溶解,进一步行三维CT扫面发现骨盆内炎性假瘤。所有患者X线片拍片均发现假体周围局灶性骨溶解,假体稳定固定。7例X线发现髋臼DeLee和Charnley II区骨溶解,1例同时伴有股骨侧外侧骨溶解(Gruen II区)。7例三维CT扫描均提示骨溶解区,其中6例CT提示骨盆内软组织包块,1例CT显示大腿前外侧软组织包快(图1)。
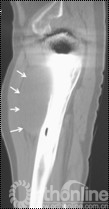
图1 CT片示股骨上段GruenII区骨溶解,外侧炎性假瘤形成(箭头所示)
7例患者入院后均行髋关节周围或大腿周围、髂窝超声检查,6例超声提示髂窝包块,呈低回声或强弱不等回声;1例大腿上段外侧包块,边界欠清晰,呈强弱不等回声信号。超声测量包块最大18cm×12cm,最小10cm×7cm。
初次THA术后至诊断假体周围炎性假瘤、骨溶解时间为4.6-8.3年,平均5.7年。所有患者WBC及分类正常,其中2例ESR和CRP升高,1例ESR 28mm/h,CRP 8.34mg/L;1例ESR 44mm/h,CRP 9.56mg/L;1例CRP升高,分别为5.76mg/L,ESR正常。
根据翻修术前影像学评估,7例均为髋臼或股骨假体稳定固定或骨长入固定,假体在系列X线片上无位置及角度改变,无移位、下沉,聚乙烯锁扣机制完整,金属臼杯无损坏,股骨假体无断裂。
三、骨溶解区位置确定及聚乙烯磨损率测量
7例术前发现假体周围炎性假瘤患者,均进行聚乙烯磨损和线性磨损率测量。聚乙烯磨损表现在骨盆正位X线片上为聚乙烯内衬不对称(图2),两侧差值为股骨头偏移距离。本组病例股骨头偏移距离为2.00mm~7.12mm,平均3.57mm。
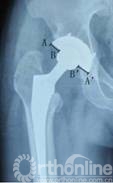
图2 X线片上AB=A’B’,表示聚乙烯无磨损,如果AB≠A’B’,则表示内外侧股骨头不对称,存在聚乙烯磨损
四、炎性假瘤外科治疗
所有炎性假瘤均行瘤样包块切除或清除。患者侧卧位,炎性假瘤位于髂窝者6例,取髂腹股沟入路,显露髂窝骨盆内侧壁髋臼内侧处。6例骨盆内侧壁处存在炎性假瘤,假瘤包块边界清晰,与周围组织无粘连,3例囊内为淡黄色砂粒、干酪样组织(图3),1例包块内为褐色沙粒样物,2例为淡黄色、半透明微混浊水样液。包块均通过髂骨内板骨缺损区与髋臼骨溶解病灶相通。仔细分离囊壁与周围组织并将囊壁完全切除。1例右股骨侧炎性假瘤患者,侧卧位患侧在上,沿原切口入路,切开深筋膜后,于股四头肌深部可触及质软包块,分离股四头肌,显露包块,包膜与股四头肌无粘连,切开包膜,见褐色沙粒样物(图4)。彻底清除褐色物,见股骨外侧部分皮质骨溶解破坏。取同种异体皮质骨板植于股骨外侧骨缺损处,多道双股钢丝环扎固定,周围植入同种异体松质骨颗粒。所用同种异体骨均来自四川省骨库,经深低温冷冻处理。

图3 髂腹股沟入路,髂窝内炎性假瘤包块,薄膜完整,薄膜内淡黄色砂粒、干酪样组织
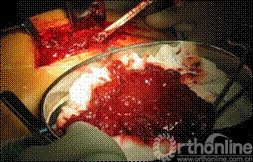
图4 股骨侧炎性假瘤,包膜与股四头肌无粘连,切开包膜,见褐色沙粒样物
7例患者均更换负重界面,其中高分子聚乙烯内衬更换为高交联聚乙烯内衬,金属头更换为陶瓷头或金属头。
五、术后处理
术前30min预防性应用抗生素,术后根据具体情况应用1-3d。术后6h后以低分子肝素抗凝,预防深静脉血栓形成。术后1-7天在助行器辅助下部分负重行走。4-6周后拍片根据植骨区骨重建修复情况逐渐过渡到完全负重。
术后1周内、1个月、3个月、6个月、1年及此后每年1次复查,术后1年随访时进行原炎性假瘤部位超声检查,观察有无炎性假瘤复发,摄X线片观察植骨区骨愈合情况、有无新发骨溶解及髋臼假体移位。
结果
本组7例获得随访,随访时间3个月-42个月,平均30个月。7例患者均至少术后获得3个月随访。获得随访的7例中,2例末次为电话随访,电话随访时随访者除询问患者一般情况、有无局部不适、疼痛等症状外,还根据Harris髋关节功能评分标准询问患者相关情况,嘱患者摄骨盆正位、髋关节正侧位X线片后邮寄至我院。
所有病例至末次随访时无特殊不适,4例术后1年时获得超声检查,无局部炎性假瘤复发。X线检查显示髋臼、股骨假体位置无变化,稳定固定,无松动迹象。4髋假体周围骨溶解区完全被骨组织替代,2髋有较好的骨长入。未出现新的髋臼周围骨溶解病灶。术后3-6个月恢复至术前活动水平。末次随访时Harris评分86-100分,平均92.4分。无浅表及深部假体周围感染、异位骨化以及假体周围骨折、深静脉血栓形成等并发症发生。无1例患者因各种原因导致失败而再次翻修。
典型病例
女,50岁,因髋关节发育不良继发骨关节炎行混合性固定(非骨水泥髋臼,骨水泥柄)THA手术。术后6年4个月发现腹股沟部渐增大、无痛性包块;体查:关节活动正常,腹股沟处可触及一10mm×10mm大小、质中等、移动度差、无触痛包块。超声检查提示右髂窝包块,呈强弱不等回声,大小约12cm×10cm,边界清楚。Harris评分88分。X线片示髋臼顶部DeLee和Charnley II区不规则低密度透光区,无连续骨小梁(图5)。CT片示髋臼假体上方DeLee和Charnley II区骨溶解区,DeLee和Charnley I、III区髋臼假体骨长入固定(图6)。WBC6.7×109/L,中性64%,ESR 28mm/h,CRP 8.34mg/L。聚乙烯线性磨损率为0.17mm/年,容积磨损率为543.42mm3/年,骨溶解区面积为412.52mm2。诊断:THA术后髋臼假体周围局灶性骨溶解(假体稳定)伴假性瘤样形成。
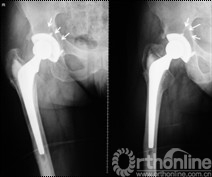
图5 翻修术前髋关节正侧位X线片示髋臼顶部DeLee和Charnley II区不规则低密度透光区(箭头所示),髋臼假体稳定固定
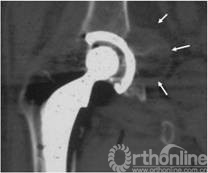
图6 CT片示髋臼假体上方DeLee和Charnley II区骨溶解, I、III区骨长入固定,髂窝内假性瘤样肉芽肿(箭头所示)
择期行双切口入路(髂腹股沟入路联合髋关节后外侧入路)右腹股沟炎性假瘤切除、骨溶解病灶清除、同种异体颗粒骨植骨、更换负重界面手术治疗。经髂腹股沟入路,见右髂窝内边界清楚,囊壁完整、质中等包块,切开囊壁,可见包块内黄色干酪样物(图7),清除干酪样物,完整切除包块囊壁,见囊壁基底位于髋臼内侧壁并与髋臼通过一直径约5mm骨缺损区相同。术后组织学可见异物吞噬反应(图8)切除髂窝炎性假瘤,经髂骨内板骨缺损区清除髋臼骨溶解病灶,同种异体颗粒骨打压植骨。髋关节后外侧入路更换高分子聚乙烯内衬为高交联聚乙烯内衬,更换钴铬钼股骨头为陶瓷头(图9)。术后2年随访,髋臼骨溶解区新生骨组织替代,髋臼假体无移位、假体稳定固定(图10),CT扫描显示骨溶解区骨长入良好,髋臼骨长入固定(图11)。Harris评分95分。超声复查无关节周围包块。
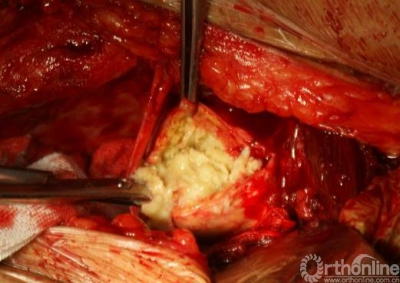
图7经髂腹股沟入路,见右髂窝内边界清楚,囊壁完整、质中等包块,切开囊壁,可见包块内黄色干酪样物

图8 术后组织学显示血细胞、纤维细胞、巨噬细胞及吞噬的异物(HE,×40)

图9 髂腹股沟入路炎性假瘤切除、骨溶解病灶清除、同种异体颗粒骨植骨,髋关节后外侧入路更换高分子聚乙烯内衬为高交联聚乙烯内衬、更换股骨头术后
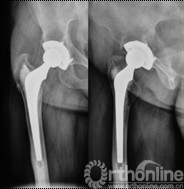
图10 术后2年随访,植骨替代吸收,髋臼骨溶解区新生骨组织替代,髋臼假体无移位、假体稳定固定
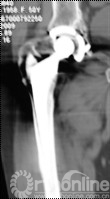
图11 术后2年随访,CT扫描显示髋臼骨溶解区新生骨组织替代,骨溶解区骨长入良好,髋臼骨长入固定
讨论
本文回顾性分析7例金属-高分子聚乙烯负重界面THA术后,发生假体周围骨溶解并伴骨盆内、髋周炎性假瘤(pseudotumor)形成病例。复习国内外相关文献,本组病例是目前据我们所知报道例数最多的一组。国外报道多为单个病例发生炎性假瘤[3,15-18],最多一组报道4例[5]。本组7例均伴有聚乙烯不对称磨损、假体周围局灶性骨溶解,但假体稳定固定,而国外文献报道部分病例并未发生明显的聚乙烯不对称磨损和局灶性骨溶解,或骨溶解范围较广导致假体松动[3,15-18]。7例患者均采接受炎性假瘤切除、骨溶解病灶清除、同种异体颗粒骨移植,更换负重界面保留假体外科治疗。
聚乙烯磨损导致THA术后假体周围骨溶解是聚乙烯负重界面THA术后常见的并发症之一,聚乙烯磨损颗粒在假体周围集聚诱发局部发生慢性炎性反应,进而导致假体周围骨溶解、假体松动[19,20]。当产生大量的磨损颗粒聚集于局部,磨损颗粒作为异物,在体内产生异物反应,并逐渐形成肉芽肿样肿物,即为炎性假瘤(pseudotumor)[5-9]。负重界面磨损产生的磨损颗粒被巨噬细胞和炎性细胞吞噬,在特定的条件下,逐渐产生局部肉芽肿样反应性增生,即异物反应,其主要临床特征为逐渐增大的肉芽肿或囊肿形成,假体周围进展性骨溶解[5-9]。Santavirta等认为[21],肉芽肿是由包括单核细胞-巨噬细胞介导的对磨损颗粒等异物的吞噬和组织碎屑的清除,在此基础上,成纤维细胞介导的细胞外基质的合成和塑形反应的结果。根据骨溶解发生的有效关节间隙理论,这种反应可发生于关节周围任何一个与关节腔想通的部位,包括骨盆内和髋关节周围[22,23]。因此,THA术后炎性假瘤多发生于骨盆、臀部等部位,而这些部位均通过不同途径与关节腔想通。本组7例患者中,6例炎性假瘤发生于骨盆内髂窝,基底部与髋臼内侧壁相对应部位、在该处通过内板局部骨缺损开口与髋臼DeleeⅡ区骨溶解病灶相交通,1例发生于股骨上段大腿前外侧。
THA术后发生炎性假瘤后可能无临床症状,或表现为局部胀满不适、隐痛。本组6例因发现下腹部胀满不适包块就诊,其中1例伴有局部隐痛,1例发现左大腿上段前外侧渐增大无痛性包块就诊。7例患者常规X线检查,均发现假体周围局灶性骨溶解(6例髋臼DeleeⅡ区、1例股骨侧GruenⅡ区),7例假体均稳定固定。但X线检查仅发现1例软组织肿胀阴影(股骨侧骨溶解伴炎性假瘤患者),其余6例在进一步接受CT检查和/或超声检查后发现炎性假瘤。当炎性假瘤发生于骨盆内,随着肿块逐渐增大,可出现下腹部不适、胀满、隐痛,当肿块压迫周围器官如膀胱、泌尿道、直肠等,可出现相应的临床症状[2,3, 5],或髋关节周围、腹股沟、臀部渐增大隐痛不适包块[1,3,2,5,24,25]。Nazarian等[3]分析他们自己的1例初次金属-高分子聚乙烯负重界面THA术后发生炎性假瘤、骨溶解病例,并复习均为单发病例报道的25例相同患者,共26例THA术后发生炎性假瘤患者中,18例既往有髋关节创伤史,或为非骨性关节炎患者。作者指出,既往有髋关节手术史或髋臼壁损伤史的患者,接受THA术后容易发生骨盆内炎性假瘤。本组7例中只有1例既往有股骨颈骨折手术史。分析本组6例发生骨盆内炎性假瘤病例,6例炎性假瘤肿块均通过基底部骨盆内板骨缺损口与髋臼骨溶解区向交通,髋臼假体稳定固定。我们推测,非骨水泥假体术后骨溶解为膨胀性骨溶解,髋臼侧局灶性骨溶解在呈膨胀性进展时,导致髋臼内侧壁骨盆内板皮质骨吸收破坏,局部形成骨缺损,使携载有聚乙烯磨损颗粒的关节液、骨溶解坏死组织通过此缺损区向压力相对较低的骨盆内突入,进而诱发局部产生慢性炎性反应,最终形成炎性假瘤。炎性假瘤产生的具体机制目前尚不完全清楚。此外,年青患者和因髋关节发育不良骨关节炎接受THA手术后,聚乙烯磨损率相对较高,更容易发生假体周围骨溶解[26,27]。本组病例接受初次THA时平均年龄39.8岁,原发疾病包括髋关节发育不良继发骨关节炎3例,股骨颈骨折内固定术后股骨头坏死1例,初次THA术后4-7年内发现假体周围骨溶解、炎性假瘤,平均5.3年。这也提醒我们,对于年轻患者接受THA术后定期随访,特别强调术后3-7年内定期随访、拍片复查的重要性,发现假体周围局灶性骨溶解时,可进一步行CT扫描,髋周、盆腔内超声检查;另一方面,对于年青患者在接受THA手术时,尽量选择耐磨损、生物活性较低的负重界面,如陶瓷-陶瓷、陶瓷/金属-高交联聚乙烯[4],以降低THA术后负重界面的磨损,进而降低假体周围骨溶解、炎性假瘤的发生。
对于THA术后臀部、下腹部、腹股沟区感胀满不适、隐痛的患者,特别是发现渐增大无痛性包块时,应及时行X线拍片检查,必要时行CT、MRI、超声检查。X线片刻发现假体周围骨溶解、聚乙烯不对称磨损、假体是否松动等异常,但是对于炎性假瘤诊断价值有限。本组仅2例患者X线检查提示异常发现,其中1例X线提示髂窝内软组织阴影,1例提示大腿上段软组织阴影。其余5例均为骨溶解处理术前常规CT检查或超声检查发现骨盆内炎性假瘤。同时还可在超声或CT介导下行肿块穿刺活检,排除感染、肿瘤等病变。
一旦发现THA术后炎性假瘤,应及时行手术治疗,切除炎性假瘤,清除骨溶解病灶,对于假体稳定固定患者,避免骨溶解进一步进展导致假体松动、假体周围骨折。清除髋周携载有磨损颗粒的肉芽肿组织,可降低或避免发生骨盆内炎性假瘤的发生。本组7例患者诊断明确后,均接受了翻修手术治疗。其中6例患者采用双切口入路[10],切除骨盆内炎性假瘤,并通过髋臼内侧壁骨缺损口最大限度的清除髋臼骨溶解病灶,植入同种异体颗粒骨,然后通过髋关节后外侧入路,进一步清除髋关节内骨溶解病灶、磨损颗粒,更换负重界面为陶瓷-高交联聚乙烯。
本文回顾性分析了7例金属-高分子聚乙烯负重界面THA术后发生假体周围局灶性骨溶解并骨盆内、大腿前外侧炎性假瘤但假体稳定固定病例,7例患者均接受炎性假瘤切除、骨溶解病灶清除、同种异体颗粒骨植骨、更换负重界面的保留假体翻修手术治疗。术后短期随访,无炎性假瘤及骨溶解复发,假体无松动,关节功能良好。分析本组病例,我们认为,对于年轻患者接受THA术后如发生假体周围局灶性骨溶解,或感下腹部、腹股沟区、臀部胀满不适隐痛、渐增大包块时,应及时行CT或超声检查,以确定或排除骨盆内、髋周发生炎性假瘤的可能。一旦发现骨盆内、髋周有炎性假瘤,并假体周围有局灶性骨溶解发生,应及时切除炎性假瘤,更换负重界面,骨缺损区植骨,可以保留稳定固定的假体,降低再次发生炎性假瘤、假体周围骨溶解发生的可能性。
参考文献
1.Leigh W, O'Grady P, M MedSci B, et al. Pelvic Pseudotumor an unusual presentation of an extra-articular granuloma in a well-fixed total hip arthroplasty. J Arthroplasty 2008; 23(6):934-938.
2.Bourghlia A, Fabrea T, Tramondb P, Durandeaua A. Total Hip Replacement pseudotumoral osteolysis. Orthopaedics Traumatology: Surgery Research 2010;96(2):319—322.
3.Nazarian DG, Zeni Jr JA. Management of a pelvic mass following a worn uncemented total hip arthroplasty. J Arthroplasty 2011;26:e1-e4.
4.康鹏德,裴福兴,王坤正. 假体周围骨溶解发生的细胞、分子生物学机制及早期诊断和药物治疗. 中华骨科杂志 2008;28(7):546-551.
5.Fabbria N, Rustemia E, Masettia C, et al. Severe osteolysis and soft tissue mass around total hip arthroplasty: Description of four cases and review of the literature with respect to clinico-radiographic and pathologic differential diagnosis. European Journal of Radiology 2011;77(1):43–50.
6.Sporer SM, Bernini PM. Extensive periacetabular osteolysis presenting as a mass on rectal examination. A case report. J Bone Joint Surg Am 2002;84(8):1439–1441.
7.Leigh W, O’Grady P, Lawson EM, et al. Pelvic pseudotumor: an unusual presentation of an extra-articular granuloma in awell-fixed total hip arthroplasty. J Arthroplasty 2008;23(6):934–938.
8. Fokter SK, Repse-Fokter A, Takac I. Case report: femoral neuropathy secondary to total hip arthroplasty wear debris. Clin Orthop Relat Res 2009;467(11):3032–3035.
9.Pandit H, Glyn-Jones S, McLardy-Smith P, et al. Pseudotumours associated with metal-on-metal hip resurfacings. J Bone Joint Surg Br 2008;90(7):847–851.
10.康鹏德, 裴福兴, 沈彬, 等. 病灶清除植骨保留髋臼假体的翻修术治疗假体周围局灶性骨溶解.中华骨科杂志 2010;30(10): 955-960.
11.Kitamura N, Leung SB, Engh Sr CA. Characteristics of pelvic osteolysis on computed tomography after total hip arthroplasty. Clin Orthop Relat Res 2005;441(12):291-235.
12.Kitamura N, Naudie DD, Leung SB, et al. Diagnostic features of pelvic osteolysis on computed tomography: the importance of communication pathways. J Bone Joint Surg Am 2005;87(7):1542-1549.
13.DeLee JG, Charnley J. Radiological demarcation of cemented sockets in total hip replacement. Clin Orthop Relat Res 1976(11-12);121:20-26.
14.Zhang H, Cheng JQ, Shen B, et al. Cementless total hip arthroplasty in Chinese patients with osteonecrosis of the femoral head. J Arthroplasty 2008,23(1):102-111.
15.DeFrang RD, Guyer WD, Porter JM, et al. Synovial cyst formation complicating total hip arthroplasty: a case report. Clin Orthop Relat Res 1996;325(2):163-165.
16.Shilt JS, Rozencwaig R, Wilson MR. Pelvic mass secondary to polyethylene and titanium alloy wear debris resulting in recurrent deep vein thrombosis. J Arthroplasty 1997;12(8):1102-1105.
17.Mak KH, Wong TK, Poddar NC. Wear debris from total hip arthroplasty presenting as an intrapelvic mass. J Arthroplasty 2001;16(5):674-677.
18.Hisatome T, Yasunga Y, Ikuta Y, et al. Hidden intrapelvic granulomatous lesions associated with total hip arthroplasty: a report of two cases. J Bone Joint Surg Am 2003;85(4):708-710.
19.Willert HG, Bertram H, Buchhorn GH. Osteolysis in all of arthroplasty of the hip:The role of ultra-high molecular weight polyethylene wear particles. Clin Orthop Relat Res 1990;258(2):324-326.
20.Abu-Amer Y, Darwech I, Clohisy JC. Aseptic loosening of total joint replacements: mechanisms underlying osteolysis and potential therapies. Arthritis Res Ther 2007;9(Suppl 1):s17-19.
21.Santavirta S, Konttinen YT, Bergroth V, et al. Aggressive granulomatous lesions associated with hip arthroplasty. Immunopathological studies. J Bone Joint Surg Am 1990;72(3):252-256..
22.Claus AM, Engh CA Jr, Hirayaman T, et al. Radiographic definition of pelvic osteolysis following total hip arthroplasty. J Bone Joint Surg Am, 2003,85:1519-1526.
23. Walsh AJ, Nikolaou VS, Antoniou J. Inflammatory pseudotumor complicating metal-on-highly cross-linked polyethylene total hip arthroplasty. J Arthroplasty 2012;27(2):324.e5-8. Mao XZ, Tay GH, Godbolt DB, et al. Pseudotumor in a well-fixed metal-on-polyethylene uncemented hip arthroplasty. J Arthroplasty 2011;e-pubshed.
25.Kobayashi S, et al. Comparative study of total hip arthroplasty between younger and older patients. Clin Orthop Relat Res 1997;339(4):618-721.
26.Chougle A, Hemmady MV, Hodgkinson JP. Long-term survival of the acetabular component after total hip arthroplasty with cement in patients with developmental dysplasia of the hip. J Bone Joint Surg Am 2006;88(1):71-79.
| 请登录|注册后发表评论! |





 京公网安备11010502051256号
京公网安备11010502051256号