人工关节置换术后感染的诊疗进展和再认识
2013-12-18 文章来源:上海交通大学医学院附属第九人民医院骨科 戴尅戎 曲新华 作者:上海交通大学医学院附属第九人民医院骨科 戴尅戎 曲新华 我要说
假体周围感染 (Periprosthetic joint infection, PJI) 是人工关节置换术后最严重的并发症。在美国,PJI是导致全膝关节置换术 (Total knee arthroplasty, TKA) 后翻修的首要原因,同时也是导致全髋关节置换术 (Total hip arthroplasty, THA) 后翻修的第三大原因。PJI的发病率在文献中报道不一,总体来说介于1-5%之间,类风湿关节炎和糖尿病患者的发病率增高。关于PJI的诊疗规范还存在较多争议,美国感染协会 (Infectious Diseases Society of America, IDSA) 于今年更新了PJI的诊疗指南 [3], 美国骨科医师协会 (American Academy of Orthopaedic Surgeons, AAOS) 于2010年发表了PJI的诊疗指南 [4],并于2012年推荐了由美国宾西法尼亚州Thomas Jefferson大学附属医院Rothman研究所Parvizi等人主持的PJI的诊疗教程 [1]。另外,骨骼肌感染协会 (Musculoskeletal Infection Society, MSIS) 也在2011年发表了PJI的诊断指南 [5,6]。目前有关于PJI主要的问题集中在:1) 假体周围感染的诊断方法有哪些发展,诊断效能如何? 2) 如何确诊假体周围感染? 3) 怎样规范处理假体周围感染? 本文基于上述指南和教程以及我科和其他作者新近发表的荟萃分析,对上述问题做一扼要介绍。
一、假体周围感染的诊断方法及其效能
至今仍未有任何一种诊断方法能够作为诊断PJI的“金标准”。目前常用的术前诊断主要为:实验室血液学检查、关节液检查、放射学检查、核医学检查等,以及术中采取标本的微生物培养和病理学检查。
1. 术前诊断
血液学检查
红细胞沉降率(ESR)和C-反应蛋白(CRP)是检测PJI的敏感指标。通常ESR和CRP在关节置换术后几日内迅速上升至峰值,在没有感染的情况下,CRP常在术后三周恢复正常,而ESR则需要更长时间恢复正常。如果术后3个月以上,二者还未恢复正常值,则考虑有假体周围感染的可能。Parvizi等发表的AAOS教程中指出,ESR更合理的指标应该在31mm/hr,而CRP则为2mg/dl。当ESR和CRP均高于上述指标,诊断假体周围感染的敏感度可达96%,但是对于部分有炎症疾病而无关节感染的患者,两种指标亦可升高,所以其特异度仅有59%,还需要配合其他检查确诊[1]。
白细胞介素-6 (IL-6) 在许多研究中被认为是诊断PJI最敏感的外周血指标,但由于血清IL-6含量较低,难以检测,所以还未作为大多数医院的常规检查方法。外周血白细胞计数(WBC)和分型(PMN)在很长一段时间被作为诊断假体周围感染的常规指标,但由于二者的敏感度和特异度的局限性,其参考度不高,能否继续作为评估假体周围感染的指标,目前还存在争议[7,8]。Berbari等的荟萃分析 (纳入了30篇文献) 指出,IL-6诊断假体周围感染的诊断比值比为314.7,CRP、ESR、WBC分别为13.1、7.2、4.4。因此目前来看,IL-6应该是优于传统血液学检查的敏感指标,如何转化,是下一步需要思考的问题。
当然,还有许多其他的检查如抗生物肽、部分促炎细胞因子等也显示出诊断PJI的优良潜力,例如人β-防御素-3(HBD-3)、抗菌肽LL-37、白介素-4(IL-4)、白介素-6(IL-6)、细胞间粘附分子-1(sICAM-1)、降钙素(PCT)等[9,10]。但上述指标仅限于实验室研究,还未得到大规模病例研究的验证。
关节液检查
关节液检查是诊断PJI的最重要的方法之一。它包括关节液培养、关节液白细胞计数、中性粒细胞分型、以及关节液CRP、ESR、其他炎症蛋白(IL-1、IL-6等)和聚合酶链反应(PCR)检查。关节液培养被认为是术前诊断PJI最有效的方法之一,我科最近的一项荟萃分析显示,关节液培养诊断PJI的敏感性为0.72,特异度为0.95。相比于THA,关节液培养对于TKA有敏感的诊断效能[11]。影响关节液培养结果的因素很多,例如抗生素的使用、关节液量以及污染等。一般建议关节液穿刺前2周停用抗生素,以提高PJI的诊断效能。关节液的白细胞计数和中性粒细胞分型同样是诊断PJI的敏感指标[11],我科的另一项待发表的荟萃分析发现,关节液的白细胞计数诊断PJI的敏感度为88%,特异度为93%;而中性粒细胞分型的敏感度为90%,特异度为88%。关节液的白细胞计数的阈值 (cut-off) 在1700个/ul,中性粒细胞分型的阈值在65%时,其诊断价值最高。但是值得引起注意的是,一些低毒力细菌致病的PJI,关节液的白细胞计数和中性粒细胞分型往往正常,这就需要关节液培养结果证实。
影像学及核医学检查
X线、CT和MRI检查,由于其各自的限制性,在诊断PJI时参考价值有限。关节造影可评估关节假体的稳定性,但关节周围组织炎症是其禁忌症。超声波检查主要适用于积液检测、穿刺引导等,对PJI的诊断效能不高 [4]。
99Tcm-亚甲基二膦酸盐(MDP)骨扫描是最早用于临床检查PJI的核素显像技术,有较高的诊断敏感度,但特异度较低。随后有学者将111ln和67Ga等放射性核素加入以进行联合扫描[4],这能够提高PJI诊断的特异度,但是由于操作增加、费用昂贵等缺点,目前联合放射性核素扫描未在临床广泛使用。99Tcm-标记的单克隆抗体如硫索单抗、BW 250/183等,被认为是优于传统放射性核素扫描的检查。Pakos等的荟萃分析指出,99Tcm-硫索单抗诊断PJI的敏感度为83%、特异度为81%,99Tcm- BW 250/183的敏感度为87%,特异度为79%。也有研究发现99Tcm-环丙沙星可以成为另一种敏感的放射性核素检查,它对THA后PJI的诊断敏感度为88%、85%,对TKA后PJI的诊断敏感度为100%和50%[12]。
另外,氟脱氧葡萄糖—正电子发射断层扫描(FDG-PET)被认为是诊断PJI最有效的放射学检查。Kwee等的荟萃分析指出,FDG-PET诊断PJI的敏感度可达82.1%,特异度可达86.6%,高于目前其他的放射学诊断方法[13]。
2.术中诊断
微生物培养
尽管术中组织培养的敏感度有限,但一直被大部分医院当做诊断PJI的“金标准”。AAOS的指南中提到 [4],当诊断标准为术中1处及以上的组织培养阳性时,其敏感度为0.73 – 0.94,特异度为0.67 – 0.91;当术中2处及以上的组织培养阳性时,其敏感度为0.54 – 0.77;特异度为0.93 – 0.99。微生物培养成功最主要的因素是细菌能否从组织中被分离出来,研究人员发现,超声波处理假体、延长细菌培养时间、反复培养、增加培养例数均能显著提高PJI的诊断效能。例如,将假体取出置于缓冲液中超声后,取缓冲液进行培养,其诊断价值比传统的术中培养高。我们先前的荟萃分析指出,超声波处理假体的缓冲液培养(Sonicate fluid cultures, SFC) 诊断PJI的敏感度和特异度可达80%和95%。另外,多例SFC培养能够提高诊断效能,敏感度和特异度均可升高至100% [14]。
病理学检查
术中滑膜、软组织及骨质等石蜡或冰冻切片组织学检查有助于辨别亚急性或隐匿性感染。术中冰冻切片被认为是一种快速有效的术中诊断PJI的方法。目前临床上常用每高倍镜(400倍)下≥5个中性粒细胞作为诊断阈值。但有的文献提出,将阈值设定在每高倍镜(400倍)下≥10个中性粒细胞能够提高诊断效能。Tsaras等的荟萃分析指出,阈值≥5时,冰冻切片诊断PJI的诊断比值比为52.6;而当阈值≥10时,诊断比值比为69.8 [15]。
3.其他检查
分子生物学检查
PCR检查是目前诊断PJI的热门方法。相较于传统培养,PCR最长只需48小时能够获得结果,在有抗生素应用史患者的样本中仍有较高的敏感度,并且能够避免传统组织培养由于未知微生物感染以致选用的培养方法不正确导致的假阴性。但同时由于操作过程中污染的可能性增加,PCR检查的假阳性值得引起重视。我们先前的一项荟萃分析指出,PCR检查对于PJI诊断的敏感度和特异度分别为86%和91%。而对于术中组织、关节液、以及超声波处理假体的缓冲液来源的样本,PCR检查的敏感度和特异度分别为:95%和81%,84%和89%以及81%和96%[16]。
二、确诊假体周围感染的步骤
MSIS组织于2011年提出了假体感染的诊断标准(图1)。而IDSA组织也提出了PJI的诊断流程 (图2)。这里值得注意的是,在术前,对于急性可疑PJI的患者,除非临床诊断明确且计划手术,否则推荐所有的患者进行关节液的诊断性穿刺(包括关节液需氧菌+厌氧菌培养)、全细胞计数、白细胞计数、中性粒细胞分型等)。另外,对于CRP或ESR不明原因升高,并伴有慢性置换部位疼痛且无其他解释的患者,亦推荐关节液的诊断性穿刺。两次或者两次以上的细菌培养结果相同的患者或关节穿刺液培养出毒力较强的细菌,可以考虑诊断为PJI。如若关节液检查结果无助于确定或改变治疗方案的患者,则无需进行关节液诊断性穿刺。对于临床症状稳定的患者,停用抗生素两周以上可以提高关节液培养的诊断效能。若患者出现发热、急性起病、或存在血液系统感染症状,则推荐进行血培养(需氧菌+厌氧菌)。

图 1 PJI的定义(译自MSIS指南)
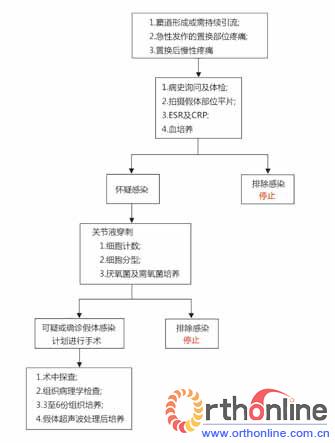
图2 PJI的确诊步骤(译自IDSA指南)
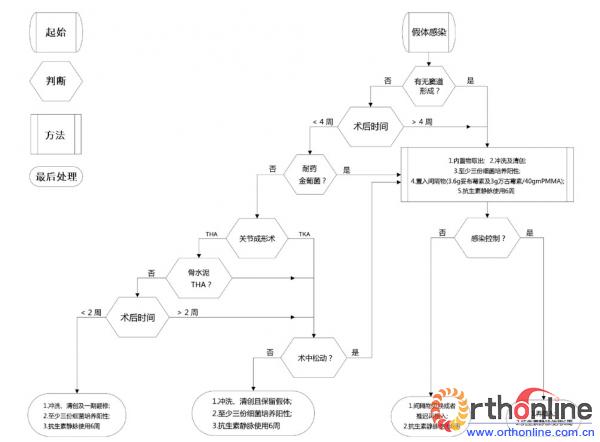
图3 PJI的处理步骤(译自AAOS推荐教程)
在术中,假体周围组织的病理学标本对诊断PJI十分重要,在清创时需至少获得3个不同部位的样本用于诊断,其最佳诊断阈值为每高倍镜(400倍)下≥5个中性粒细胞。对于细菌培养,如若患者临床症状稳定,可考虑术前停用抗生素两周以上,以提高术中组织培养的诊断效能。另外,术前及术中培养结果均为同一种细菌时,或软组织内培养出毒力较强的细菌,也可考虑诊断PJI。如果多个培养样本中只有一个标本培养出毒力较低的细菌,通常可能是标本污染所致,需要结合其他检查进行确诊。
假体周围感染(PJI)定义
根据此标准,在下列情况发生时定义为假体周围感染:
1) 发现与关节相通的窦道;或者
2) 从感染假体周围取得的两个或两个以上标本中均培养、分离出病原菌;或者
3) 当下列六种情况中存在四种时:
a. ESR及CRP水平升高,
b. WBC计数升高,
c. PMN%升高,
d. 受感染关节周围发现脓液,
e. 从1例假体周围组织标本中培养、分离出细菌
f. 400倍显微镜下观察假体组织切片,在5个或以上高倍镜视野下观察到至少5个中性粒细胞/视野。
注意:满足少于4个上述条件时,也可能为假体感染。
又:在特定低致病性细菌感染 (如P.acnes) 的情况下,即使上述情况不足四种,也可诊断为假体感染。
三、规范处理假体周围感染
AAOS组织推荐Parvizi医师所在的宾西法尼亚州Thomas Jefferson大学附属医院处理PJI的流程和经验作为教程 (图3)。其中需要注意的是,确诊PJI后首先要明确:症状持续时间、患者的免疫状态及身体健康状况、病变关节及其他关节PJI病史、任何关节的伤口状态、关节功能预期、以及致病菌的特性等,这些均有助于手术治疗方案的选择。患者全身状况差,致病菌毒力低且抗生素敏感,首选单纯性抗菌治疗。二期手术是北美地区治疗PJI的标准方法,即一期取出假体并安放骨水泥间隔,待感染控制后再二期植入新的假体。有研究认为,对于急性感染的病例,如果假体位置、固定较好且周围组织覆盖佳,致病菌对抗生素敏感,可以采用保留假体、清创灌洗的方式以减轻病残;但如果致病菌为金黄色葡萄球菌,或耐甲氧西林的金黄色葡萄球菌,这种手术方式常常会失败。而Parvizi等的教程指出,单纯行关节灌洗并保留假体的成功率低,不宜常规进行。对于生物型THA术后早期(2周内)的急性非MASA感染的患者,他们通常采用一期清创+更换假体。
对于反复二期翻修亦不能控制感染,且患者肢体功能恢复可能性较低、免疫功能低下、全身状况差无法耐受多次手术,则需考虑关节融合术、截肢等。
小结
PJI是关节置换术后最严重的并发症。针对PJI的诊断方法在不断的改进当中,仍没有一项检查方法能够作为PJI诊断的“金标准”。及时准确的判断假体感染,特别是与假体无菌性松动和金属过敏的鉴别,是保证PJI规范治疗的前提。
参考文献
1 Parvizi J, Adeli B, Zmistowski B, et al. Management of periprosthetic joint infection: the current knowledge: AAOS exhibit selection. J Bone Joint Surg Am, 2012, 94: e104.
2 Trampuz A, Piper KE, Jacobson MJ, et al. Sonication of removed hip and knee prostheses for diagnosis of infection. N Engl J Med, 2007, 357: 654-663.
3 Osmon DR, Berbari EF, Berendt AR, et al. Diagnosis and management of prosthetic joint infection: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis, 2013, 56: e1-e25.
4 Parvizi J, Della Valle CJ. AAOS Clinical Practice Guideline: diagnosis and treatment of periprosthetic joint infections of the hip and knee. J Am Acad Orthop Surg, 2010, 18: 771-772.
5 Workgroup Convened by the Musculoskeletal Infection S. New definition for periprosthetic joint infection. J Arthroplasty, 2011, 26: 1136-1138.
6 Parvizi J, Zmistowski B, Berbari EF, et al. New definition for periprosthetic joint infection: from the Workgroup of the Musculoskeletal Infection Society. Clin Orthop Relat Res, 2011, 469: 2992-2994.
7 Zmistowski B, Restrepo C, Huang R, et al. Periprosthetic joint infection diagnosis: a complete understanding of white blood cell count and differential. J Arthroplasty, 2012, 27: 1589-1593.
8 Toossi N, Adeli B, Rasouli MR, et al. Serum white blood cell count and differential do not have a role in the diagnosis of periprosthetic joint infection. J Arthroplasty, 2012, 27: 51-54 e51.
9 Gollwitzer H, Dombrowski Y, Prodinger PM, et al. Antimicrobial peptides and proinflammatory cytokines in periprosthetic joint infection. J Bone Joint Surg Am, 2013, 95: 644-651.
10 Drago L, Vassena C, Dozio E, et al. Procalcitonin, C-reactive protein, interleukin-6, and soluble intercellular adhesion molecule-1 as markers of postoperative orthopaedic joint prosthesis infections. Int J Immunopathol Pharmacol, 2011, 24: 433-440.
11 Qu X, Zhai Z, Wu C, et al. Preoperative aspiration culture for preoperative diagnosis of infection in total hip or knee arthroplasty. J Clin Microbiol, 2013: 10.1128/JCM.01467-01413.
12 Fuster D, Soriano A, Garcia S, et al. Usefulness of 99mTc-ciprofloxacin scintigraphy in the diagnosis of prosthetic joint infections. Nucl Med Commun, 2011, 32: 44-51.
13 Kwee TC, Kwee RM, Alavi A. FDG-PET for diagnosing prosthetic joint infection: systematic review and metaanalysis. Eur J Nucl Med Mol Imaging, 2008, 35: 2122-2132.
14 Janz V, Wassilew GI, Hasart O, et al. Improvement in the detection rate of PJI in total hip arthroplasty through multiple sonicate fluid cultures. J Orthop Res, 2013.
15 Tsaras G, Maduka-Ezeh A, Inwards CY, et al. Utility of intraoperative frozen section histopathology in the diagnosis of periprosthetic joint infection: a systematic review and meta-analysis. J Bone Joint Surg Am, 2012, 94: 1700-1711.
16 Qu X, Zhai Z, Li H, et al. PCR-based diagnosis of prosthetic joint infection. J Clin Microbiol, 2013, 51: 2742-2746.





 京公网安备11010502051256号
京公网安备11010502051256号