基于TRPV4和PIEZO1离子通道的多样化软骨细胞力转导通路
2017-04-21 作者:苏州大学附属第一医院 袁章琴 李斌(骨科在线编委会基础组副主编) 点击量:3639 我要说
力学敏感性通道(Mechanosensitive channel,MSC)是一种能够感受细胞膜力学刺激并迅速作出反应的离子通道,与细胞骨架一起构成细胞的力学感受系统,将膜感受到的力学信号转化为电信号或化学信号。自从2010年Piezo家族(包括Piezo 1和Piezo 2)被首次鉴定为真正完全意义上的力学敏感性离子通道蛋白后,Piezo离子通道便逐渐进入研究者的研究视野。多项研究表明Piezo蛋白在多种细胞中都可调控力学刺激引起的阳离子内流,与机体一些生理病理过程有关,其中Piezo 1基因及其表达的蛋白与机体一些生理病理过程有关,如小鼠血管的发育,红细胞的形状,皮肤Merkel细胞的感觉等。2014年PNAS报道,小鼠关节软骨受到力学刺激时Piezo 1表达量增加,引发钙离子转运的增强。用Piezo 抑制剂GsMTx4处理软骨细胞或者特异性siRNA 干扰软骨细胞Piezo 1表达后,Ca2+转运受到明显抑制,但在遭受过度应力时,可通过抑制Piezo 1调控的力传导减轻软骨损伤和创伤性关节炎。此外,在压力刺激条件下,用特异性拮抗剂GSK205封闭软骨细胞TRPV4离子通道后,会显著抑制软骨细胞基质生成;反之,用其激动剂处理后,会促进细胞基质产生。人类TRPV4基因变异会引发关节机能障碍,Trpv4-/-基因敲除小鼠模型也增加了对肥胖和衰老导致的骨关节炎的敏感性。
力学敏感性离子通道在软骨细胞力学传导中起着非常重要的功能性作用,但其作用机制尚未十分明确。为此,德国Max-Delbruck分子医学中心用高速压力膜片钳和弹性体微柱阵列向小鼠原代软骨细胞施加不同的力学刺激,即分别向细胞膜施加牵张力或通过胞外基质接触点予以力学刺激,同时检测细胞膜电流,以研究TRPV4 和PIEZO1 离子通道在力电传导(mechanoelectrical transduction)中的作用。研究发现TRPV4和PIEZO1 离子通道都可促进受细胞周围ECM刺激激活的电流,但只有PIEZO1 离子通道可调控细胞膜牵张刺激激活的电流。
在软骨内,力学刺激是通过细胞周围的ECM转移到软骨细胞的。为了检测与基质接触的细胞膜区域是否是力电传导过程中的重要元件,研究者将小鼠原代软骨细胞种植在 PDMS弹性微柱阵列上,每一微柱有确定的尺寸,且每个细胞—基质接触点面积为10μm2。利用玻璃探针(被压电元件驱动)推动单根微柱使其偏转,可以在细胞—基质接触点向细胞直接施加一系列精确的力学刺激(图1A)。结果表明,88.9%的软骨细胞和88.2%去分化细胞在力学刺激下诱发产生了内向电流(图1B)。电流动力学显示,去分化细胞的延迟时间和激活时间常量皆显著低于软骨细胞(图1C)。软骨细胞和去分化细胞在此过程中呈现显著不同的力学敏感性,去分化细胞对于基质接触点的偏转刺激更为敏感,但是两种细胞对拉伸力学刺激诱发的电流并无显著差异(图2)。

图1.小鼠软骨细胞力电传导激活电流。(A) 通过外力使微柱偏转,从而对细胞—基质接触点施加偏转力学刺激; 左:微柱阵列实验示意图,偏转微柱与细胞的接触点给予力学刺激的同时用全细胞膜片钳检测电流变化。(蓝色表示 刺激探针,橙色表示膜片钳吸头) ;右:种植于微柱阵列中的软骨细胞图片。连续移动高亮微柱的图片证明移动程度与力学刺激相对应。 (B) 偏转刺激诱发软骨细胞的力电传导电流;软骨细胞明视场图像以及对应偏转刺激诱发的电流(红色)。(C) 偏转刺激诱发分化细胞的力电传导电流;分化细胞明视场图像以及对应偏转刺激诱发的电流(蓝色) 。 (D) 电流动力学比较;左:延迟时间 (洋红色),激活时间常量(t1,蓝色) 和电流减弱时间 (t2, 绿色)。右:各组指标数据单独表示(软骨细胞:红色,去分化细胞:蓝绿色)。
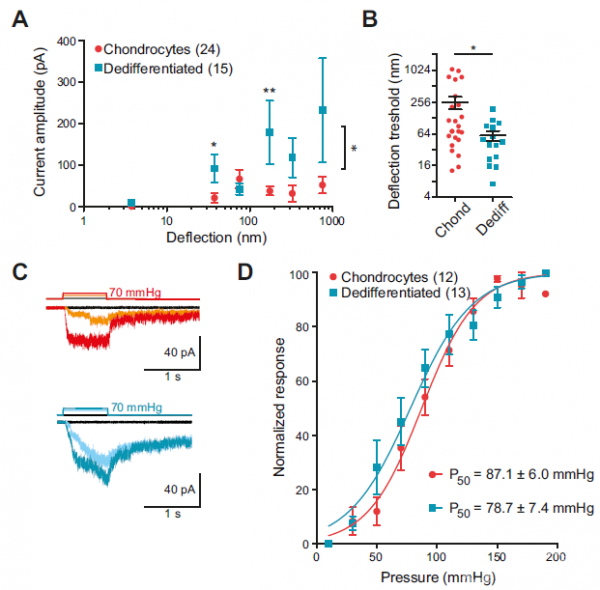
图2. 软骨细胞和去分化细胞呈现明显差异的力学敏感性。 (A) 软骨细胞和去分化细胞对基质偏转刺激的反应图。(B) 软骨细胞和去分化细胞基于不同的基质偏转呈现明显不同的阈值。 (C)用HSPC分别记录来自于软骨细胞(上)和去分化细胞(下)牵张激活的电流。(D)压力刺激软骨细胞 (红色) 和去分化细胞(蓝绿色)诱发电流的反应曲线。
用miRNA抑制软骨细胞Piezo1表达后,对基质偏转力学刺激反应的细胞数量显著降低(图3A),只有50%,说明Piezo1的敲低降低了力电传导(图3B)。从Trpv4-/-小鼠分离出来的软骨细胞也仅有46.2%会对基质偏转力学刺激产生反应,显著低于野生型小鼠软骨细胞(88.9%)且在刺激反应中电流振幅存在显著差异(图3C)。这说明正常小鼠软骨细胞对来自于基质力学刺激进行传导时需要Piezo1和Trpv4,但都不是必要条件。因为在单独敲除任一通道基因表达后,软骨细胞仍能对力学刺激做出反应。但通过往Trpv4-/-软骨细胞中-转染Piezo1-靶向miRNA同时敲除两个通道基因后,几乎无细胞对基质力学刺激做出反应,残存的微弱电流可能源于Piezo1的不完全敲除(图3D)。此外,无论用Piezo1激活剂Yoda1处理软骨细胞还是用Trpv4激动剂GSK1016790A处理软骨细胞,都能显著增强基质力学刺激诱发的Ca2+信号,这说明这两种离子通道蛋白都在关节软骨活细胞细胞膜中表达,且呈活跃状态。
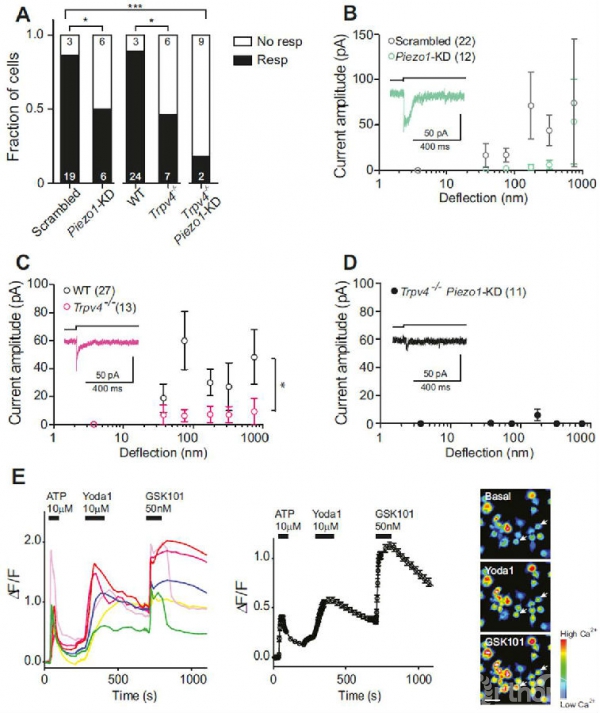
图3. PIEZO1 和TRPV4.对基质偏转激活电流的调控。(A)不同处理对偏转刺激产生反应的软骨细胞比例。 (B) 抑制Piezo1的软骨细胞在基质偏转刺激下反应图 (C) Trpv4-/- 敲除小鼠软骨细胞对基质偏转刺激的反应敏感性显著低于野生型小鼠软骨细胞 (D) 转染有Piezo1-靶向 miRNA 的Trpv4-/- 软骨细胞对基质偏转刺激的反应。(E)用Yoda1 and GSK1016790A处理后的软骨细胞在基质偏转刺激过程中的钙离子荧光成像。
进一步考察在小鼠原代软骨细胞细胞膜牵张刺激时,TRPV4离子通道和PIEZO1离子通道的活性。研究表明,在软骨细胞敲除Piezo1后,由胞膜牵张刺激引发的峰值电流4.1±0.8 pA,显著小于对照组72.8±14.3 pA;但Trpv4-/- 小鼠软骨细胞与野生型小鼠软骨细胞胞膜牵张诱发峰值电流却无显著差异(图4A)。Trpv4-/- 小鼠软骨细胞转染Piezo1靶向miRNA后,与转染无意miRNA的野生型小鼠软骨细胞相比,牵张诱发的峰值电流显著降低(图4)。这一结果证明随着Piezo1的敲除,胞膜牵张力激活的电流也在衰退,Piezo1离子通道在软骨细胞牵张诱发电流过程中起着重要作用,而TRPV4离子通道在这一特异性力电传导通路中未见明显作用。

图4. 小鼠软骨细胞牵张敏感性电流依赖于PIEZO1离子通道,不依赖于TRPV4。 (A) 不同处理组软骨细胞膜牵张引起的最大电流的比较;Trpv4-/-软骨细胞牵张敏感性峰值电流与野生型小鼠软骨细胞无明显差异;但Trpv4-/- chondrocytes转染Piezo1-靶向 miRNA 后导致牵张敏感性峰值电流的显著降低。 (B) HSPC 检测的各组电流示踪图。
本研究由德国柏林Max-Delbruck分子医学中心Gary R Lewin和Kate Poole团队完成,2017年1月30日发表于eLife。
论文信息:
M RocioServin-Vences, Mirko Moroni, Gary R Lewin*, Kate Poole*. Direct measurement ofTRPV4 and PIEZO1 activity reveals multiple mechanotransduction pathways in chondrocytes.eLife 2017,6: e21074





 京公网安备11010502051256号
京公网安备11010502051256号